UTI – Les tests de culture traditionnels sont-ils obsolètes ?
Date de publication : Mars 2020
Les infections des voies urinaires sont le type d’infection bactérienne le plus courant1, représentant au moins 11 millions de visites au cabinet du médecin, 2 à 3 millions de visites aux urgences, 400 000 hospitalisations et environ 2,3 milliards de dollars en coûts de soins de santé chaque année aux États-Unis2,3,4,5.
Ce formidable fardeau pour les patients et le système de santé ne cesse de croître – par exemple, les tendances au vieillissement de la population et la prolifération des bactéries résistantes aux antimicrobiens amplifient le besoin de soins intensifs et la mortalité hospitalière due aux infections urinaires.6,7
Ces facteurs renforcent la nécessité de diagnostiquer les infections urinaires et d’optimiser la thérapie antimicrobienne de manière efficace et précise. Cependant, les nouvelles méthodes de test et notre compréhension émergente du microbiome urinaire soulèvent des questions sur la pertinence de la culture d’urine traditionnelle. Dans cet article, je passe en revue les principaux types d’infections urinaires, les approches actuelles de l’utilisation de la culture d’urine et des tests de sensibilité, les preuves récentes du microbiome urinaire, les nouveaux tests disponibles dans le commerce et les approches futures de la détection des infections urinaires, y compris les nouveaux biomarqueurs et les algorithmes d’apprentissage automatique.
Infections urinaires non compliquées par rapport aux infections urinaires compliquées
Distinguer les infections urinaires non compliquées des infections urinaires compliquées est une première étape essentielle pour guider la prise en charge. Les infections urinaires non compliquées sont l’un des types d’infections les plus couramment traités dans les établissements de soins primaires. Les femmes sont les plus exposées, avec une incidence à vie proche de 50 % et un taux de récidive d’environ 33 %.8
La majorité des patients souffrant d’une infection urinaire non compliquée sont des femmes préménopausées qui ne sont pas enceintes et présentent peu ou pas de comorbidités. Ces patients présentent généralement des symptômes de cystite, tels que la dysurie, la fréquence et l’urgence.9 La douleur sus-pubienne et l’hématurie sont rares, et la pyélonéphrite n’est pas présente.
Les infections urinaires compliquées touchent généralement les patients des deux sexes qui présentent des anomalies structurelles ou fonctionnelles des voies urinaires.9 Ces patients ont souvent subi des interventions urologiques antérieures, une exposition récente aux antibiotiques, un cathétérisme récent ou de longue durée, ou une hospitalisation récente ou en cours (infections urinaires nosocomiales). Les autres groupes à haut risque sont les femmes enceintes, les patients atteints de diabète sucré et les patients présentant d’autres conditions d’immunodépression.
Les patients atteints d’infections urinaires compliquées présentent généralement des symptômes de pyélonéphrite, notamment de la fièvre, des frissons et des douleurs au flanc, avec ou sans nausées. Ils peuvent avoir un antécédent confirmé ou suspecté d’infection(s) par des bactéries plus virulentes. Les cultures d’urine peuvent révéler un microbiote diversifié et des schémas de résistance aux antimicrobiens supérieurs à la moyenne. Malheureusement, ces deux facteurs peuvent compromettre l’efficacité d’un traitement antimicrobien.
Quand envisager une culture d’urine et sa sensibilité
Historiquement, l’étalon-or diagnostique des infections urinaires consistait à réaliser une culture d’urine standard (c’est-à-dire à étaler 1 microlitre d’urine à mi-course sur des géloses au sang de mouton à 5% et McConkey et à les incuber en aérobiose).1 Dans ce contexte, l’infection urinaire était définie comme la présence d’un uropathogène isolé et connu à une concentration de >105 UFC/ml ou >102 UFC/ml chez un patient symptomatique. Compte tenu de la prévalence élevée des infections urinaires et du fait que la culture d’urine n’est pas un test de point-of-care, il convient de se demander quand il est possible de renoncer à la culture sans compromettre les résultats du traitement.
Les directives actuelles de l’Infectious Diseases Society of America (IDSA) ne recommandent pas la culture d’urine standard de routine pour les patients suspectés d’avoir des infections urinaires non compliquées.10 Il existe de nombreuses preuves que l’analyse d’urine est informative dans ce contexte. Dans une étude, environ 94 % des patients dont l’analyse d’urine était négative présentaient également une culture négative.11 Dans une étude longitudinale rétrospective portant sur près de 21 000 patientes ambulatoires, une analyse d’urine négative était associée à une probabilité 2,5 fois plus élevée de culture négative (<103 CFU/ml) par rapport à une analyse d’urine positive.12 Chez les patientes présentant des symptômes récurrents d’infection urinaire, une analyse d’urine ou une culture d’urine négative antérieure ou une irritation ou un écoulement vaginal actuel étaient associés à une augmentation statistiquement significative de la probabilité d’une culture négative.
L’estérase leucocytaire est particulièrement informative lors de l’évaluation des infections urinaires non compliquées suspectées. Dans une vaste étude rétrospective portant sur plus de 8 500 patients de ce type, un résultat négatif pour l’estérase leucocytaire permettait de prédire un résultat de culture urinaire négatif avec une précision de 95 % (valeur prédictive négative, 0,95), tandis que les résultats négatifs à la fois pour l’estérase leucocytaire et le nitrate n’étaient que légèrement plus précis (valeur prédictive négative combinée, 0,96).13 Il convient de noter qu’un résultat négatif pour le nitrate seul était nettement moins fiable pour prédire un résultat de culture négatif (valeur prédictive négative, 0,87).
Pour les patients souffrant d’infections urinaires non compliquées, les directives de l’IDSA recommandent de choisir parmi les médicaments suivants pour un traitement antimicrobien empirique :10
– Nitrofurantoïne 100mg deux fois par jour (BID) pendant 5 jours
– Triméthoprime/sulfaméthoxazole (Bactrim DS) pendant 3 jours si les taux de résistance locaux sont <20% (si vous n’avez pas déjà accès à ces données, pensez à contacter les services de santé locaux, du comté ou de l’état).
– Fosfomycine (dose unique de 3 grammes)
– Notez que les fluoroquinolones telles que la ciprofloxacine ne sont plus recommandées pour les infections urinaires non compliquées en raison des taux élevés de résistance dans certaines régions
En outre, la sélection de la thérapie antimicrobienne pour les infections urinaires non compliquées doit être guidée par les modèles locaux de résistance aux antimicrobiens et la meilleure supposition éclairée du clinicien quant à l’uropathogène le plus probable. Dans une étude portant sur plus de 9 000 femmes présentant des infections urinaires non compliquées confirmées par culture, 19 % des isolats étaient résistants au triméthoprime-sulfaméthoxazole et 12 % étaient résistants à la nitrofurantoïne (10 % étaient résistants à la ciprofloxacine, qui n’est plus recommandée pour un traitement empirique).14 Les prédicteurs significatifs de la résistance aux antimicrobiens comprenaient le fait de vivre dans un code postal présentant des taux de résistance aux antimicrobiens supérieurs à la moyenne, d’avoir des antécédents d’infection par un uropathogène résistant ou de s’être vu prescrire un traitement antimicrobien au cours des deux dernières années. Sur la base de ces données, les investigateurs ont développé un algorithme qui a sélectionné une thérapie antimicrobienne appropriée dans 92% des cas, dépassant le taux de choix du fournisseur de 87,5%.
En conclusion, pour les patients atteints d’infections urinaires non compliquées, une culture d’urine traditionnelle n’est pas obsolète, mais dans la plupart des cas, elle est inutile.
Pour les patients suspectés d’avoir des infections urinaires compliquées, les cliniciens doivent choisir le traitement antimicrobien initial (empirique) en fonction des données historiques de culture et de sensibilité, si elles sont disponibles, en plus des résultats actuels de l’analyse d’urine et des schémas locaux de résistance aux antimicrobiens. Si l’analyse d’urine est négative et que le patient a des antécédents de cultures négatives, il y a 87 % de probabilité que les symptômes actuels ne soient pas causés par une infection des voies urinaires, selon des données récentes.12 Ces patients doivent être évalués pour d’autres causes de leurs symptômes, comme le syndrome de douleur pelvienne chronique (SPPC) ou des tumeurs des voies urinaires. Si l’analyse d’urine est positive, je recommande alors de traiter de manière empirique et de demander une culture et une sensibilité de l’urine afin de modifier le traitement si nécessaire.
L’urine n’est pas stérile
Jusqu’à très récemment, le paradigme de la prise en charge des infections non compliquées et compliquées consistait à éliminer les micro-organismes des voies urinaires. Les experts reconnaissent maintenant que cette approche est limitée par deux facteurs clés liés : les microbiotes sont présents dans les voies urinaires asymptomatiques (saines) et la culture standard est relativement peu sensible pour la détection des micro-organismes urinaires.
Des preuves solides et de plus en plus nombreuses de l’existence d’un microbiome urinaire diversifié remettent en question la vieille maxime clinique selon laquelle » l’urine est stérile « .15 Dans une étude récente, les chercheurs ont réalisé une PCR quantitative de l’ARN ribosomique 16S à partir de 16 échantillons d’urine provenant d’hommes et de femmes en bonne santé âgés de 26 à 90 ans.16 Cinq échantillons ont été testés positifs pour un phylum bactérien et un à six genres, tandis que les autres contenaient en moyenne cinq phyla et huit à 36 genres. Dans une autre étude, les chercheurs ont réalisé un séquençage PCR à haut débit d’échantillons d’urine provenant de huit femmes, qui avaient toutes des cultures d’urine standard négatives.17 Tous les échantillons étaient polymicrobiens et présentaient une variabilité considérable entre les échantillons : 45 espèces bactériennes uniques ont été identifiées, dont neuf étaient associées à des infections des voies urinaires et 20 avaient un potentiel pathogène inconnu. Des études similaires ont confirmé ce résultat18, suggérant que l’urine d’individus sains contient fréquemment des bactéries que les cultures urinaires standard ne détectent pas.
Une autre étude a approfondi le sujet en utilisant la culture d’urine quantitative améliorée (EQUC) pour déterminer si les bactéries identifiées dans les échantillons d’urine étaient viables.19 Cette méthode implique l’ensemencement de plus grands volumes d’urine, l’incubation des échantillons dans un plus large éventail de conditions de croissance et l’utilisation de périodes d’incubation plus longues. Parmi les 65 échantillons d’urine évalués par l’EQUC, 80 % ont produit des bactéries, dont 92 % n’ont pas été détectées par la culture standard. Trente-cinq genres ont été identifiés, dont les plus courants sont Lactobacillus, Corynebacterium, Streptococcus, Actinomyces et Staphylococcus. La plupart des espèces bactériennes se répliquaient à des nombres inférieurs au seuil de détection des protocoles standard de culture d’urine. Ces résultats ont été confirmés par une autre étude récente portant sur 150 adultes (la moitié d’entre eux signalant des symptômes urinaires), dans laquelle l’utilisation de l’EQUC a permis de détecter 182 uropathogènes, soit trois fois le nombre détecté par la culture standard.20
Collectivement, les résultats de ces études confirment que divers microbiotes urinaires sont présents à la fois chez les personnes en bonne santé et chez les patients présentant des symptômes urinaires, et que les méthodes de culture urinaire standard sont relativement peu sensibles pour caractériser ce microbiome, y compris les uropathogènes. Les cultures standard ne simulent pas non plus de manière fiable les biofilms, tels que ceux qui se forment dans les cathéters urinaires, et les résultats finaux des cultures standard et des tests de sensibilité nécessitent plusieurs jours avant d’être communiqués.11,21 Il est clair qu’il y a place à l’amélioration.
Nouveaux tests commerciaux pour les infections des voies urinaires
Trois tests urinaires commerciaux détectent les uropathogènes avec une plus grande sensibilité que la culture d’urine standard et dépistent également rapidement les preuves de résistance aux antimicrobiens (tableau 1).18,19,22 Les avantages potentiels de ces tests comprennent une identification plus rapide des agents pathogènes, des résultats de sensibilité plus précis et un traitement individualisé, qui peuvent tous théoriquement améliorer les résultats des patients23,24,25.
Le test Vikor Urine-ID™ est un test basé sur la PCR qui est capable de détecter plusieurs espèces de bactéries et qui peut également identifier jusqu’à 30 gènes bactériens codant pour la résistance aux agents antimicrobiens.26 Les résultats du test sont disponibles en 12 à 24 heures environ (tableau 1). Avec les résultats des tests, le fabricant fournit des informations sur les schémas régionaux de sensibilité aux antimicrobiens, les spectres d’activité des antibiotiques, les coûts des médicaments et les conseils pertinents de la Food and Drug Administration (FDA) des États-Unis.
Le kit d’analyse d’urine MicroGenDX UTI est un test en deux étapes.27 Premièrement, la PCR quantitative est utilisée pour dépister 16 types de bactéries ainsi que Candida albicans, avec des résultats fournis dans les 24 heures. Ensuite, le séquençage de nouvelle génération (NGS) est utilisé pour comparer l’ADN du microbiote de l’échantillon d’urine avec une base de données de plus de 30 000 espèces microbiennes, avec des résultats en 3 à 5 jours (Tableau 1). Selon le fabricant, le kit d’analyse urinaire de l’infection urinaire identifie tous les microbes présents dans un échantillon d’urine avec une précision de 99,9 %.
Tableau 1. Vue d’ensemble des nouveaux tests commerciaux pour les infections urinaires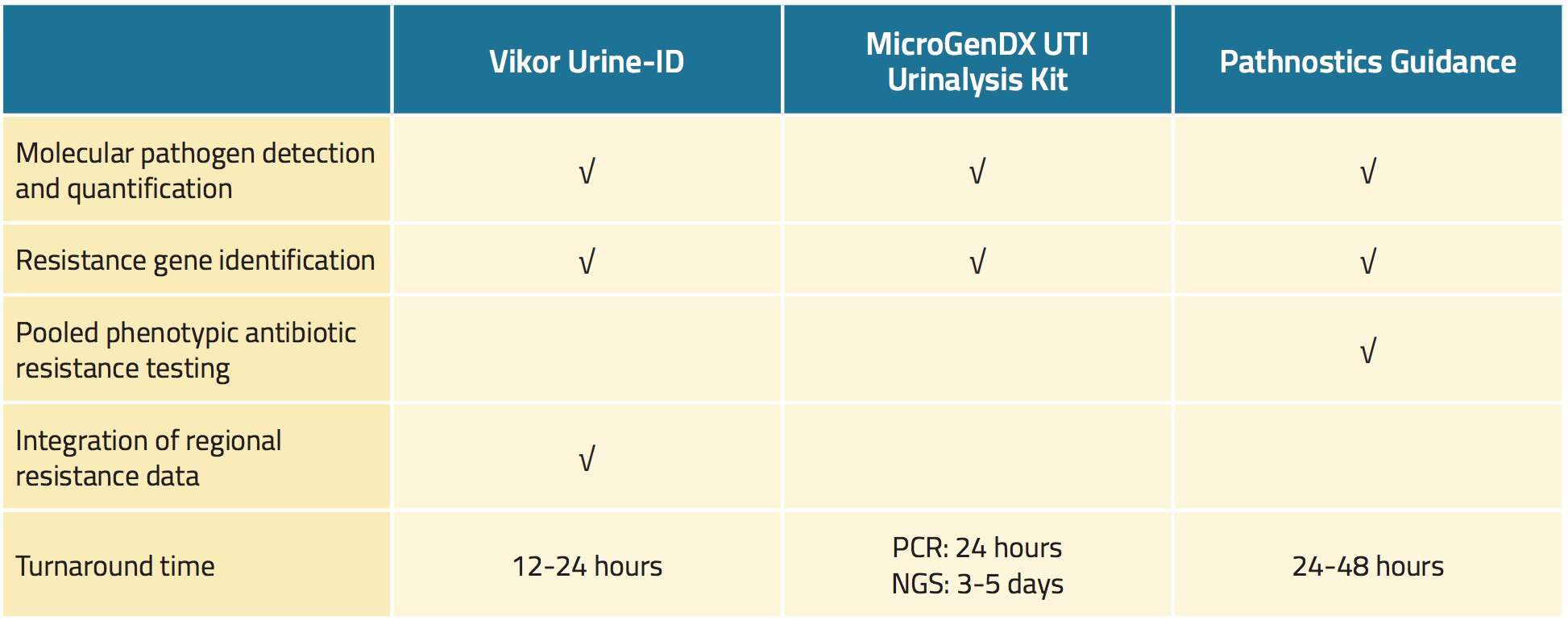
Le test Pathnostics Guidance consiste en une suite de nouveaux tests urinaires pour les patients atteints de prostatite, de cystite interstitielle et d’infections urinaires récurrentes.28 Le test pour l’infection du tractus utilise la PCR pour dépister 45 agents pathogènes et 38 gènes de résistance. Le test Pathnostics Guidance génère également des données phénotypiques et des résultats groupés de sensibilité aux antimicrobiens. Le test peut utiliser de l’urine vidée ou recueillie par cathéter, qui peut être conservée à température ambiante pendant 5 jours. Les résultats sont disponibles en 24 à 28 heures.
Une mise en garde mérite d’être mentionnée. Comme nous l’avons évoqué, ces tests très sensibles peuvent détecter des bactéries dans l’urine de personnes asymptomatiques et de personnes dont les symptômes ne sont pas liés à des infections urinaires. Par conséquent, les cliniciens ne doivent pas fonder leurs décisions de traitement sur les seuls résultats des tests. Cela peut avoir des conséquences négatives pour les patients. Dans une étude portant sur 673 femmes jeunes et d’âge moyen présentant une bactériurie asymptomatique et des antécédents d’infections urinaires récurrentes, la moitié des patientes ont reçu un traitement antimicrobien alors que les autres n’en ont pas reçu.22 Lors du suivi à 6 mois et à 12 mois, le traitement antimicrobien était associé à une augmentation statistiquement significative des taux de récurrence des symptômes urinaires. Pour éviter la surutilisation d’agents antimicrobiens et les effets secondaires, les coûts et la sélection de la résistance aux antimicrobiens qui y sont associés, il est essentiel que les cliniciens évaluent les résultats des tests dans le contexte du risque global et des antécédents d’infections urinaires des patients et de la présentation clinique actuelle.
Directives futures pour les tests urinaires
Même si les tests récemment approuvés sont sur le point d’améliorer considérablement la détection et la gestion des infections urinaires par rapport à la culture standard seule, les chercheurs continuent de chercher des moyens d’améliorer le diagnostic, la détection des agents pathogènes, la quantification de la sensibilité aux antimicrobiens et les algorithmes de traitement. Les exemples incluent l’utilisation de techniques d’apprentissage automatique, des analyses composites de nouveaux biomarqueurs et des tests de signatures de protéines cellulaires.
Les algorithmes d’apprentissage automatique se sont révélés très prometteurs pour améliorer la détection et l’évaluation des patients atteints d’infections urinaires non compliquées. Par exemple, une étude a évalué 17 variables cliniques et 42 variables immunologiques pour identifier les meilleurs prédicteurs des résultats de la culture d’urine. La turbidité de l’urine était le meilleur prédicteur clinique, avec une valeur prédictive positive de 0,65 (ce qui signifie que la présence d’une turbidité de l’urine identifie un échantillon positif pour la culture avec une précision de 65 %) et une valeur prédictive négative de 0,65.79 (ce qui signifie que l’absence de turbidité de l’urine permet d’identifier un échantillon négatif pour la culture avec une précision de 79 %).29 Par conséquent, la turbidité de l’urine est relativement peu sensible mais présente une spécificité raisonnable pour la détection d’un échantillon positif pour la culture. Ensemble, quatre biomarqueurs urinaires – la métallopeptidase matricielle 9, la lipocaline associée à la gélatinase des neutrophiles, l’interleukine (IL)-8 et l’IL-1β – ont atteint une valeur prédictive positive nettement supérieure de 0,82 et une valeur prédictive négative comparable de 0,76. Bien que la combinaison de ces quatre biomarqueurs urinaires avec la turbidité de l’urine n’ait pas amélioré davantage ces valeurs prédictives, les résultats de l’étude indiquent que les algorithmes d’apprentissage automatique peuvent identifier de manière fiable la plupart des patients atteints d’infections urinaires non compliquées.29
A mesure que les modèles d’apprentissage automatique s’affinent, leurs valeurs prédictives pourraient s’améliorer, ce qui pourrait encore améliorer le diagnostic et le traitement des infections urinaires dans les populations vulnérables tout en réduisant simultanément la charge de travail en matière de diagnostic. Par exemple, une vaste étude récente a analysé plus de 212 000 rapports de résultats de microscopie, de culture et de sensibilité de l’urine provenant de trois hôpitaux et services ambulatoires en Grande-Bretagne.30 Des algorithmes d’apprentissage automatique spécifiques ont été conçus pour les sous-groupes à haut risque, tels que les femmes enceintes, les enfants et les personnes souffrant d’infections urinaires persistantes ou récurrentes. L’apprentissage automatique a détecté environ 95 % des spécimens positifs à la culture, tout en réduisant la charge de travail associée à la culture d’urine d’environ 41 % et en obtenant une spécificité supérieure d’environ 24 % à celle d’un modèle heuristique basé sur la numération des globules blancs et des bactéries. Ces résultats sont particulièrement remarquables à une époque où le vieillissement de la population et l’émergence de bactéries résistantes aux antimicrobiens renforcent la nécessité de détecter efficacement et précisément les infections urinaires qui nécessitent un traitement.
On a constaté que les infections urinaires récurrentes (historiquement définies comme au moins deux infections urinaires au cours des 6 derniers mois, ou plus de trois infections au cours de la dernière année) touchent environ 50 % des femmes de plus de 55 ans et 27 % des femmes plus jeunes31, 32 Les directives actuelles préconisent une prise en charge intensive avec des mesures telles que l’antibiothérapie prophylactique, la limitation de l’utilisation des spermicides, la vidange après les rapports sexuels, la prophylaxie immunitaire avec OM-89, la vaccination vaginale avec Urovac et l’utilisation de crèmes ou d’anneaux d’œstrogènes vaginaux chez les femmes en post-partum31, 33 L’analyse des biomarqueurs sériques et urinaires pourrait aider à mieux prédire quels patients développeront des infections récurrentes des voies urinaires afin qu’ils bénéficient d’interventions plus précoces et ciblées32. Les biomarqueurs pertinents pour les infections urinaires récurrentes comprennent des taux sériques réduits de vitamine D et d’antigène spécifique de la prostate, des taux sériques accrus d’immunoglobulines, de facteur de stimulation des colonies de granulocytes, de facteur de stimulation des colonies de macrophages et d’IL-5, tandis que les biomarqueurs urinaires pertinents comprennent des taux élevés d’IL-8 et des taux réduits de facteur de croissance nerveuse et de lipocaline associée à la gélatinase des neutrophiles.
Les diagnostics futurs pourraient également inclure des tests de biomarqueurs au point de service qui complètent ou réduisent la nécessité de cultures d’urine. Un test idéal serait aussi rapide et peu coûteux qu’une bandelette urinaire, mais plus précis et exact. Les candidats potentiels comprennent la triméthylamine et l’acétate, qui sont des marqueurs du métabolisme bactérien, et la xanthine oxydase et la myéloperoxydase, qui sont des biomarqueurs enzymatiques.34
Les futurs tests pourraient également évaluer l’exosome urinaire comme biomarqueur potentiel des infections urinaires. L’exosome est constitué de petites vésicules extracellulaires qui transportent des protéines cellulaires. Dans une étude, les protéines urinaires Akt (une protéine de signalisation intracellulaire) et CD9 (une protéine transmembranaire intracellulaire) étaient significativement élevées chez les femmes souffrant d’infections urinaires par rapport aux femmes présentant une bactériurie asymptomatique, et les niveaux des deux protéines diminuaient significativement après un traitement antimicrobien35. Les résultats de ces études pourraient un jour faciliter le développement de tests commerciaux qui évaluent l’exosome urinaire pour aider à guider la prise de décision en matière de traitement.
Résumé
L’évaluation et la gestion des infections urinaires font partie intégrante de la pratique de l’urologie. Pour les infections urinaires non compliquées, la culture d’urine est généralement inutile, et un traitement empirique selon les directives actuelles de l’IDSA est approprié. Le traitement empirique basé sur les résultats historiques de la culture et de la sensibilité est également approprié pour les infections urinaires compliquées, mais doit être modifié en fonction de la culture et de la sensibilité actuelles. Les infections urinaires récurrentes peuvent justifier la nécessité d’interventions thérapeutiques et comportementales intensives.
Bien qu’il s’agisse de nos meilleures pratiques actuelles, elles laissent une place substantielle à l’amélioration, en particulier si l’on considère les preuves récentes de l’existence d’un microbiome urinaire et les limites du dépistage et de la culture standard. Il est nécessaire de disposer de tests rapides et fiables pour mieux détecter les uropathogènes, différencier une dysbiose urinaire cliniquement significative d’une bactériurie cliniquement sans conséquence, et orienter la thérapie antimicrobienne sur la base de données de résistance personnalisées. Des tests de sensibilité basés sur la PCR quantitative et le séquençage de nouvelle génération sont désormais disponibles. À l’avenir, l’utilisation de méthodes quantitatives améliorées de culture d’urine pourrait également améliorer les soins cliniques. Les chercheurs évaluent également des algorithmes d’apprentissage automatique qui intègrent des biomarqueurs sériques et urinaires et d’autres variables cliniques afin de détecter plus efficacement les infections urinaires, de prédire les récidives et de réduire la charge de travail en matière de diagnostic. L’intégration de ces nouvelles approches aux données sur la résistance locale et les réadmissions à l’hôpital pourrait accroître leur utilité. L’objectif final est de développer des tests sensibles, spécifiques, rentables et des algorithmes pratiques qui améliorent la gestion et les résultats pour les patients.
Écrit par : Edward Schaeffer, MD, Ph.D., président du département d’urologie de l’école de médecine Feinberg, directeur de programme, programme d’oncologie génito-urinaire, Robert H. Lurie Comprehensive Cancer Center, Northwestern University, Chicago, Illinois
1. Schaeffer, AJ., Matulewicz, RS., & Klumpp, DJ. (2016). Infections de l’appareil urinaire. Dans AJ. Wein, & et al (Eds.), Campbell-Walsh Urology, Eleventh Edition Philadelphia : Elsevier-Saunders.
2. Schappert, S. M., et E. A. Rechtsteiner. « Estimations de l’utilisation des soins médicaux ambulatoires pour 2007 ». Statistiques de l’état civil et de la santé. Série 13, Données de l’enquête nationale sur la santé 169 (2011) : 1-38.
3. Foxman, Betsy. « Syndromes d’infection des voies urinaires : occurrence, récurrence, bactériologie, facteurs de risque et charge de morbidité ». Infectious disease clinics of North America 28, no 1 (2013) : 1-13.
4. Foxman, Betsy. « L’épidémiologie de l’infection des voies urinaires ». Nature Reviews Urology 7, no. 12 (2010) : 653.
5. Simmering, Jacob E., Fan Tang, Joseph E. Cavanaugh, Linnea A. Polgreen, et Philip M. Polgreen. « L’augmentation des hospitalisations pour infections urinaires et les coûts associés aux États-Unis, 1998-2011 ». In Open forum infectious diseases, vol. 4, no. 1. Oxford University Press, 2017.
6. Nguyen, Hoa Q., Nga TQ Nguyen, Carmel M. Hughes et Ciaran O’Neill. » Tendances et impact de la résistance aux antimicrobiens sur les patients hospitalisés âgés atteints d’infections urinaires (IU) : A national retrospective observational study ». PloS one 14, no 10 (2019).
7. Critchley, Ian A., Nicole Cotroneo, Michael J. Pucci et Rodrigo Mendes. « Le fardeau de la résistance aux antimicrobiens parmi les isolats d’Escherichia coli dans les voies urinaires aux États-Unis en 2017 ». PloS one 14, no 12 (2019).
8.Gupta, Kalpana, et Barbara W. Trautner. « Diagnostic et gestion des infections urinaires récurrentes chez les femmes non enceintes ». Bmj 346 (2013) : f3140.
9. Tan, Chee Wei, et Maciej Piotr Chlebicki. « Infections des voies urinaires chez les adultes ». Singapore medical journal 57, no 9 (2016) : 485.
10. Gupta, Kalpana, Thomas M. Hooton, Kurt G. Naber, Björn Wullt, Richard Colgan, Loren G. Miller, Gregory J. Moran et al. « International clinical practice guidelines for the treatment of acute uncomplicated cystitis and pyelonephritis in women : a 2010 update by the Infectious Diseases Society of America and the European Society for Microbiology and Infectious Diseases. » Maladies infectieuses cliniques 52, no. 5 (2011) : e103-e120.
11. Huang, Bin, Lei Zhang, Weizheng Zhang, Kang Liao, Shihong Zhang, Zhiquan Zhang, Xingyan Ma et al. « Détection et identification directes des pathogènes bactériens à partir de l’urine avec un traitement optimisé des échantillons et un algorithme de test amélioré. » Journal de microbiologie clinique 55, no. 5 (2017) : 1488-1495.
12. Cohen, Jason E., Emily M. Yura, Liqi Chen et Anthony J. Schaeffer. « Utilité prédictive des cultures d’urine négatives antérieures chez les femmes présentant des infections urinaires récurrentes suspectées non compliquées. » Le Journal de l’urologie 202, no. 5 (2019) : 979-985.
13. Marques, Alexandre Gimenes, Jacyr Pasternak, Márcio dos Santos Damascena, Carolina Nunes França et Marinês Dalla Valle Martino. « Performance du test de dépistage par bandelette comme prédicteur d’une culture d’urine négative ». Einstein (São Paulo) 15, no 1 (2017) : 34-39.
14. Cohen, Jason E., Liqi Chen et Anthony J. Schaeffer. « Les algorithmes utilisant la résistance antérieure, les prescriptions antimicrobiennes antérieures et le lieu de résidence du patient améliorent le traitement empirique des femmes souffrant d’infections urinaires non compliquées. » Urologie 137 (2020) : 72-78.
15. Finucane, Thomas E. « ‘infection urinaire’ et le microbiome ». The American journal of medicine 130, no. 3 (2017) : e97-e98.
16. Lewis, Debbie Ann, Richard Brown, Jon Williams, Paul White, Susan Kim Jacobson, Julian Marchesi et Marcus John Drake. « Le microbiome urinaire humain ; l’ADN bactérien dans l’urine mictionnelle d’adultes asymptomatiques ». Frontiers in cellular and infection microbiology 3 (2013) : 41.
17. Siddiqui, Huma, Alexander J. Nederbragt, Karin Lagesen, Stig L. Jeansson, et Kjetill S. Jakobsen. « Évaluation de la diversité du microbiote urinaire féminin par séquençage à haut débit des amplicons d’ADNr 16S ». BMC microbiology 11, no. 1 (2011) : 244.
18. Wolfe, Alan J., Evelyn Toh, Noriko Shibata, Ruichen Rong, Kimberly Kenton, MaryPat FitzGerald, Elizabeth R. Mueller et al. « Evidence of uncultivated bacteria in the adult female bladder ». Journal of clinical microbiology 50, no. 4 (2012) : 1376-1383.
19. Hilt, Evann E., Kathleen McKinley, Meghan M. Pearce, Amy B. Rosenfeld, Michael J. Zilliox, Elizabeth R. Mueller, Linda Brubaker, Xiaowu Gai, Alan J. Wolfe et Paul C. Schreckenberger. » L’urine n’est pas stérile : utilisation de techniques de culture d’urine améliorées pour détecter la flore bactérienne résidente dans la vessie des femmes adultes « . Journal de microbiologie clinique 52, no. 3 (2014) : 871-876.
20. Price, Travis K., Tanaka Dune, Evann E. Hilt, Krystal J. Thomas-White, Stephanie Kliethermes, Cynthia Brincat, Linda Brubaker, Alan J. Wolfe, Elizabeth R. Mueller et Paul C. Schreckenberger. « La culture d’urine clinique : des techniques améliorées améliorent la détection des micro-organismes cliniquement pertinents ». Journal de microbiologie clinique 54, no. 5 (2016) : 1216-1222.
21. Sathiananthamoorthy, Sanchutha, James Malone-Lee, Kiren Gill, Anna Tymon, Trang K. Nguyen, Shradha Gurung, Linda Collins et al. « Réévaluation de la culture de routine en milieu de parcours dans le diagnostic de l’infection urinaire. » Journal de microbiologie clinique 57, no. 3 (2019) : e01452-18.
22. Cai, Tommaso, Sandra Mazzoli, Nicola Mondaini, Francesca Meacci, Gabriella Nesi, Carolina D’Elia, Gianni Malossini, Vieri Boddi et Riccardo Bartoletti. « Le rôle de la bactériurie asymptomatique chez les jeunes femmes présentant des infections urinaires récurrentes : traiter ou ne pas traiter ? ». Clinical infectious diseases 55, no 6 (2012) : 771-777.
23. Lehmann, Lutz E., Stefan Hauser, Thomas Malinka, Sven Klaschik, Stefan U. Weber, Jens-Christian Schewe, Frank Stüber et Malte Book. « Identification qualitative rapide des agents pathogènes des infections urinaires par PCR en temps réel SeptiFast® « . PLoS One 6, no 2 (2011).
24. Schmidt, K., K. K. Stanley, R. Hale, L. Smith, J. Wain, J. O’grady, et D. M. Livermore. « Evaluation of multiplex tandem PCR (MT-PCR) assays for the detection of bacterial resistance genes among Enterobacteriaceae in clinical urines ». Journal of Antimicrobial Chemotherapy 74, no 2 (2019) : 349-356.
25. Barczak, Amy K., James E. Gomez, Benjamin B. Kaufmann, Ella R. Hinson, Lisa Cosimi, Mark L. Borowsky, Andrew B. Onderdonk et al. « Les signatures ARN permettent une identification rapide des agents pathogènes et des sensibilités aux antibiotiques. » Proceedings of the national academy of sciences 109, no 16 (2012) : 6217-6222.
26. Urine-IDTM – Vikor Scientific. https://www.vikorscientific.com/test-menu/urine-id/. Consulté le 15 février 2020.
27. Trousse d’urine UTI – Assurance | MicroGen Diagnostics. https://microgendx.com/product/urine-kit-ins/. Consulté le 15 février 2020.
28. Orientation – Pathnostics. https://www.pathnostics.com/physicians/tests/guidance/. Consulté le 15 février 2020.
29. Gadalla, Amal AH, Ida M. Friberg, Ann Kift-Morgan, Jingjing Zhang, Matthias Eberl, Nicholas Topley, Ian Weeks et al. « Identification de biomarqueurs cliniques et urinaires pour l’infection urinaire non compliquée à l’aide d’algorithmes d’apprentissage automatique. » Scientific Reports 9, no 1 (2019) : 1-11.
30. Burton, Ross J., Mahableshwar Albur, Matthias Eberl et Simone M. Cuff. « Utilisation de l’intelligence artificielle pour réduire la charge de travail de diagnostic sans compromettre la détection des infections des voies urinaires ». BMC medical informatics and decision making 19, no 1 (2019) : 171.
31. Bonkat, G., R. Pickard, R. Bartoletti, F. Bruyere, S. E. Geerlings, et F. Wagenlehner. « Lignes directrices sur les infections urologiques. Lignes directrices de l’EAU. » Association européenne d’urologie (2017).
32. Jhang, Jia-Fong, et Hann-Chorng Kuo. « Progrès récents dans l’infection urinaire récurrente, de la pathogenèse et des biomarqueurs à la prévention. » Tzu-Chi Medical Journal 29, no. 3 (2017) : 131.
33. Dason, Shawn, Jeyapandy T. Dason, et Anil Kapoor. « Lignes directrices pour le diagnostic et la prise en charge de l’infection urinaire récurrente chez la femme ». Journal de l’Association urologique canadienne 5, no. 5 (2011) : 316.
34. Karlsen, H., et T. Dong. « Biomarqueurs des infections des voies urinaires : état de l’art, et applications prometteuses pour les capteurs chimiques rapides à base de bandes. » Analytical Methods 7, no 19 (2015) : 7961-7975.
35. Mizutani, Kosuke, Kyojiro Kawakami, Kengo Horie, Yasunori Fujita, Koji Kameyama, Taku Kato, Keita Nakane et al. » L’exosome urinaire comme biomarqueur potentiel de l’infection des voies urinaires. » Microbiologie cellulaire 21, no 7 (2019) : e13020.
Contenu connexe:
Téléchargement : Urologie au quotidien : Volume 5, numéro 1