H2S Lewis Structure, Molecular Geometry, Hybridization and Polarity
Hydrogen Sulfide is a common chemical compound that is useful for analyzing inorganic compounds of metal ions. It has the chemical formula of H2S. The molecule has two Hydrogen atoms and a single Sulfur atom. H2S is also a precursor for elemental Sulfur. It also plays a vital role in signaling pathways in the human body. So to understand the hybridization, polarity, and molecular geometry of this compound, it is essential to know its Lewis structure.
| Name of molecule | Hydrogen Disulfide ( H2S) |
| No of Valence Electrons in the molecule | 8 |
| Hybridization of CO2 | sp3 hybridization |
| Bond Angles | 104.5 degrees |
| Molecular Geometry of CO2 | Bent |
Before knowing its Lewis structure, let us calculate the total number of valence electrons in Hydrogen Sulfide as these electrons participate in bond formation and help us study Lewis structure with ease.
Contents
Valence electrons of H2S
To know the total number of valence electrons in Hydrogen Sulfide we need to add the valence electrons of both Hydrogen and Sulfur atoms. There are two atoms of Hydrogen and a single atom of Sulfur in the compound.
Each Hydrogen atom has only one electron which is also its valence electron
Hence there are two valence electrons for Hydrogen atom ( as there are two Hydrogen atoms)
Sulfur has six valence electrons.
Total number of valence electrons in H2S
= 2(1) + 6
= 8
Thus, there are a total of eight valence electrons in H2S.
H2S Lewisstructuur
De Lewisstructuur van een verbinding is een structurele weergave van de valentie-elektronen die deelnemen aan de bindingsvorming, samen met de niet-bindende elektronenparen. Kennis van de Lewis-structuur van een bepaalde chemische verbinding is essentieel, omdat deze de nodige informatie verschaft over alle andere chemische eigenschappen van de verbinding.
De voorstelling wordt weergegeven met stippen en lijnen die elektronen voorstellen. De stippen staan voor de elektronen die niet deelnemen aan de bindingsvorming. Terwijl de lijnen de bindingen in de verbinding voorstellen. De structuur is gemaakt op basis van de Octetregel. De Octet Regel van de scheikunde stelt dat er acht elektronen in de buitenste schil van een element moeten zijn om stabiel te zijn.
De Lewisstructuur van Waterstofsulfide is eenvoudig te tekenen en te begrijpen. In deze verbinding hebben beide waterstofatomen één elektron nodig om de covalente binding met zwavel te maken. De Lewisstructuur van H2S is vergelijkbaar met H2S. Zwavel heeft acht elektronen nodig om aan de eisen van de octetregel te voldoen. Maar Waterstof heeft slechts één elektron nodig om stabiel te worden, omdat het tot Groep 1 elementen behoort.
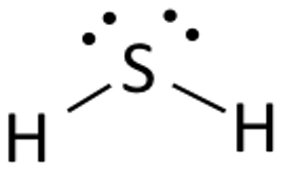
Plaats het Zwavelatoom in het midden en rangschik de valentie-elektronen eromheen.
Plaats nu twee waterstofatomen aan weerszijden van het centrale atoom.
Hier worden de valentie-elektronen van Zwavel gebruikt om Waterstof stabiel te maken door een elektron af te staan aan de beide waterstofatomen. Twee van de zes valentie-elektronen nemen deel aan de bindingsvorming.
Teken lijnen (om bindingen aan te geven) tussen waterstof- en zwavelatomen.
De resterende vier elektronen zijn niet-bindende elektronen en zijn daarom als stippen weergegeven bij het Zwavelatoom. In totaal zijn er twee paar niet-bindende elektronen in deze verbinding en hebben de waterstofatomen een volledige valentieschil.
H2S Hybridisatie
Om de hybridisatie van H2S te begrijpen, is het van vitaal belang eerst twee dingen te weten:
- Het aantal bindingen in de verbinding en het type daarvan
Het is essentieel om het type binding in de verbinding te kennen om de hybridisatie te kennen. In het H2S-molecuul vormen twee waterstofatomen een binding met het centrale zwavelatoom. Er worden twee enkelvoudige bindingen gevormd in het molecuul. Deze bindingen nemen vier valentie-elektronen in beslag, en dus blijven er vier andere valentie-elektronen over. Tijdens het vormen van een binding overlapt de s-baan van het waterstofatoom met de p-baan van het zwavelatoom. Het eenzame elektronenpaar neemt twee van de sp3-banen in. De overige twee banen van sp3 overlappen met de 1s baan van het Waterstofatoom.
Deze opstelling leidt tot de sp3 hybridisatie van het H2S molecuul. De overlapping van de twee-hybride banen vormt twee sigma-bindingen tussen Waterstof- en Zwavelatoom.
- Het sterische getal van de gegeven verbinding
Het sterische getal wordt gedefinieerd als het gebied van elektronendichtheid dat rond het centrale atoom te zien is. Aangezien in dit geval zwavel het centrale atoom is, is het sterische getal van de verbinding het cumulatieve totaal van de atomen die aan het centrale atoom zijn gebonden en het aantal eenzame elektronenparen rond het centrale atoom.
De formule om dit getal te vinden is:
Sterisch getal (SN)
= aantal sigma-bindingen op het centrale atoom + aantal pi-loontjesparen op het centrale atoom
In dit geval van H2S-moleculen zijn er twee sigma-bindingen, en zijn er twee lone-paren van elektronen op het centrale atoom.

Thus SN van H2S molecuul = 2+2
=4
Als het Sterisch getal van H2S vier is, heeft het twee
hybride orbitalen en twee eenzame elektronenparen die het een sp3 hybridisatie maken.
Nu we de Lewis-structuur en hybridisatie van het molecuul kennen, is het gemakkelijk om de moleculaire geometrie te bepalen.
H2S Moleculaire geometrie
Hybridisatie van het gegeven molecuul H2S is sp3; het Zwavelatoom is in centrumbinding met twee Waterstofatomen die de bindingshoek kleiner dan 180 graden vormen. Volgens de VSEPR-theorie stoten de eenzame elektronenparen elkaar af, maar omdat het Zwavelatoom minder elektronegatief is, neemt de bindingshoek af tot 104,5 graden.
Deze afname van de hoek leidt tot een gebogen structuur.
Een andere manier om de moleculaire geometrie te kennen is met de AXN-methode. Waarbij A staat voor het centrale atoom, X voor het aantal gebonden elektronenparen en N voor het eenzame elektronenpaar. Hier zal de algemene formule AX2N2 zijn vanwege twee bindingsparen en twee eenzame elektronenparen. Dit molecuul vertoont dus een gebogen geometrie.
H2S polariteit
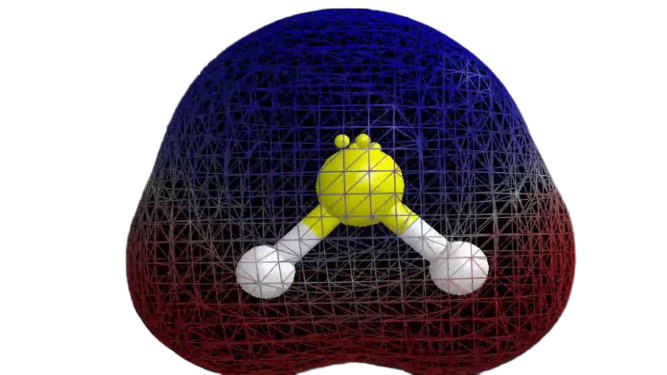
Nu we de vereiste informatie over het molecuul hebben, is het gemakkelijk om de polariteit ervan te bepalen. De polariteit van een bepaald molecuul hangt af van de moleculaire geometrie en de algemene elektronegativiteit. Aangezien het zwavelatoom minder elektronegatief is, is de totale elektronegativiteit van de verbinding minder dan 0,4, waardoor het niet polair is.
Dus kan worden gezegd dat het H2S-molecuul niet polair is.
Conclusie
Uit bovenstaande informatie kan worden geconcludeerd dat het H2S-molecuul acht valentie-elektronen, sp3 hybridisatie, gebogen moleculaire geometrie heeft, en niet polair is.