Hoe werkt een autobatterij en hoe zit hij in elkaar?
De traditionele functie van de batterij in de motorruimte is welbekend: Zonder de accu kan het voertuig niet worden gestart. Naast de startmotor hebben ook de bougies, gloeibougies, verlichting en elektronische toepassingen allemaal elektrische energie nodig. Maar hoe zit een batterij in elkaar en hoe werkt hij?
Loodzuur-batterijen: Componenten en structuur
Veel automobilisten worden zich bewust van het zware gewicht van autoaccu’s wanneer ze een nieuwe kopen. Gewichten van ongeveer 10,5 kg, tot 30 kg zijn mogelijk. De reden hiervoor zijn de loden platen in de batterijcellen.
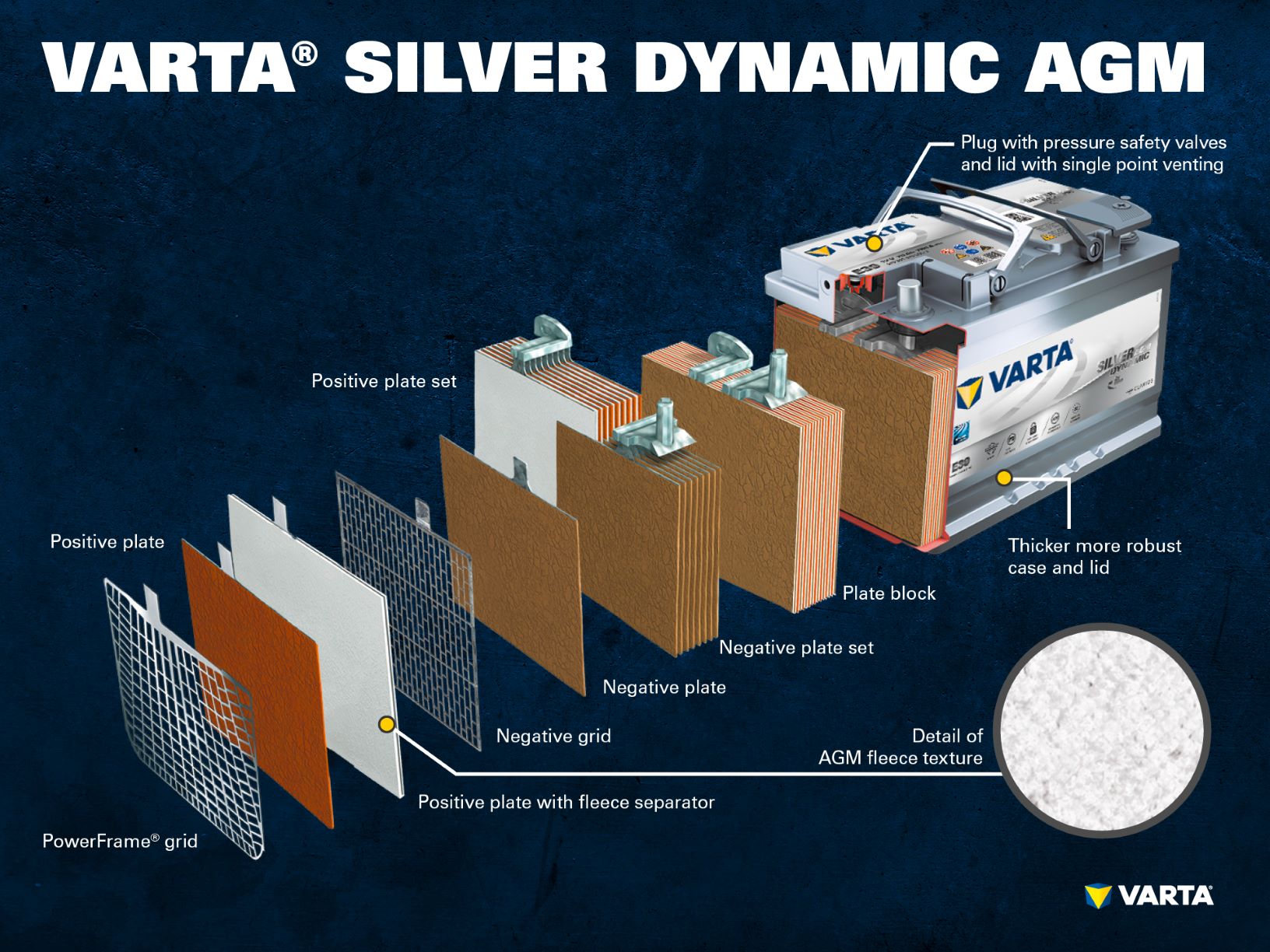
Componenten en structuur van een batterijcel
Positieve elektrode:
- Positieve plaat: In een loodzuur-batterij bestaat de positief geladen plaat (actief materiaal) uit loodoxide (PbO2) dat is ondergedompeld in een elektrolyt.
- Positief rooster: Het positieve rooster bestaat uit een loodlegering en wordt gebruikt om het actieve materiaal vast te houden en als stroomcollector.
Negatieve elektrode:
- Negatieve plaat: De negatief geladen plaat (actief materiaal) bestaat uit zuiver lood (Pb), dat eveneens in een elektrolyt is ondergedompeld.
- Negatieve plaat: Net als de positieve plaat bestaat ook deze uit een loodlegering en dient hetzelfde doel.
De elektroden met verschillende lading worden gescheiden door een scheidingszak.
De elektrolyt is een mengsel van zwavelzuur (H2SO4) en gedestilleerd water. Dit elektrolyt kan vloeibaar zijn (zoals in conventionele natte batterijen of in de verbeterde EFB-technologie), in gelvorm, of gebonden in een glasmat (zoals in de AGM-technologie voor nieuwere start-stoptoepassingen).
Verschillende positieve elektroden vormen een positieve plaat en verschillende negatieve elektroden vormen een negatieve plaat. Een negatieve en een positieve set platen vormen samen een platenblok. Een platenblok is een batterijcel.
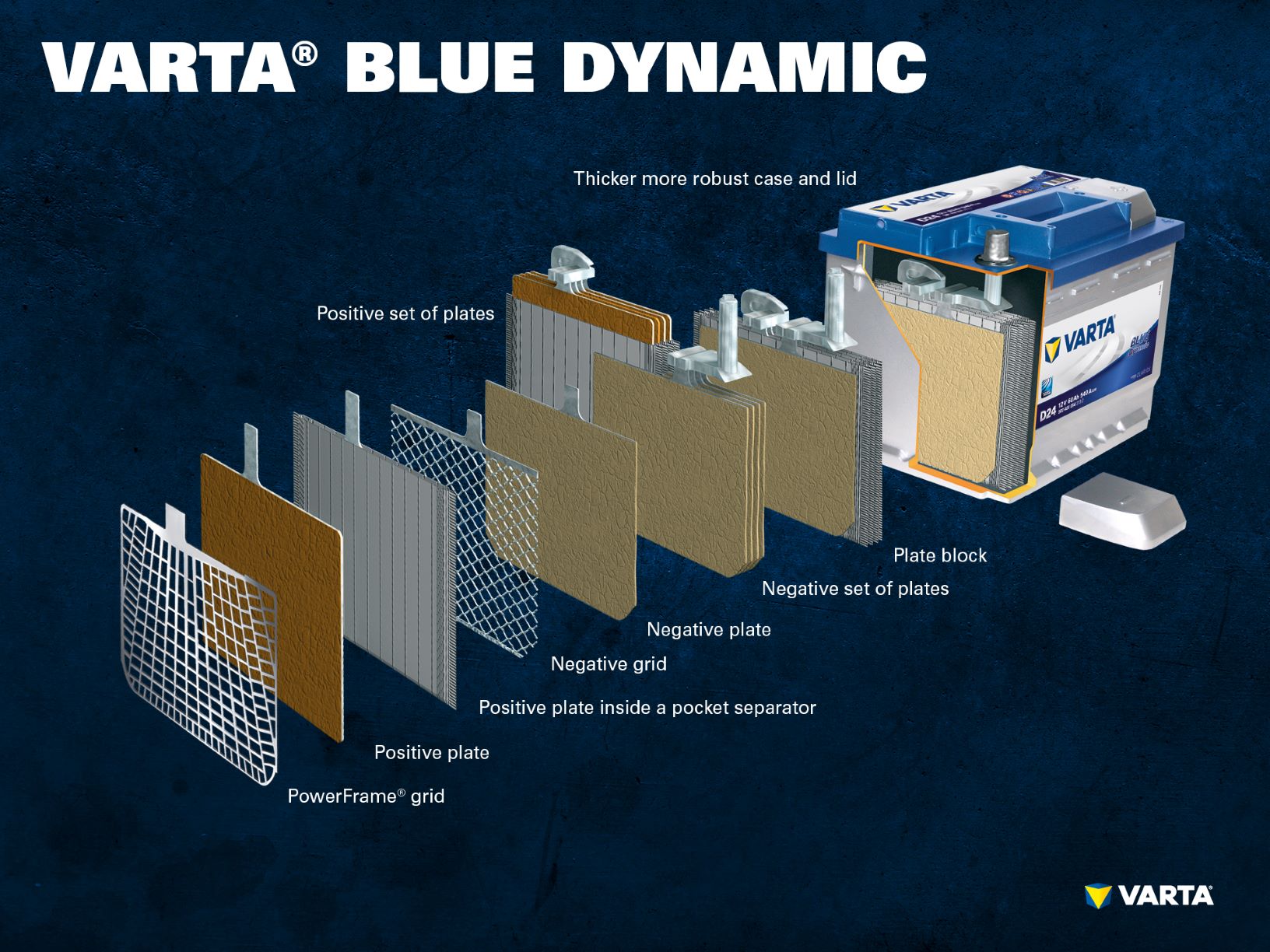
Een conventionele startbatterij bestaat uit 6 cellen die in serie zijn geschakeld, elk met een nominale spanning van 2 V, wat resulteert in een spanning van precies 12,72 V wanneer de batterij volledig is opgeladen. De capaciteit en het vermogen tot koud starten van de batterij worden bepaald door het aantal platen per cel.
Vuistregel: Hoe meer platen een cel bevat, en dus een groter oppervlak vormt, hoe groter het koudstartvermogen (CCA) dat de batterij kan leveren. Als de ruimte in de cel echter wordt gebruikt voor minder, maar dikkere platen, wordt de cyclusstabiliteit vergroot. Dit betekent dat de batterij is ontworpen voor een hogere laaddoorvoer (continu laden en ontladen).
De cellen zitten in een behuizing die is gemaakt van zuurbestendige kunststof (polypropyleen). In een conventionele SLI-batterij is deze afgesloten met een deksel met een labyrintsysteem dat voorkomt dat de batterijvloeistof ontsnapt en dat de vloeistof scheidt van het gas.
Eerdere batterijen hadden schroefdoppen waarmee ze konden worden bijgevuld met gedestilleerd water. Moderne batterijen zijn volledig onderhoudsvrij. Water hoeft niet te worden bijgevuld, en dat moet ook niet. Hoewel AGM-batterijen nog steeds “eenrichtingsstekkers” hebben, mogen deze in geen geval worden geopend.
De functie van de autoaccu: Chemische energie wordt elektrische energie
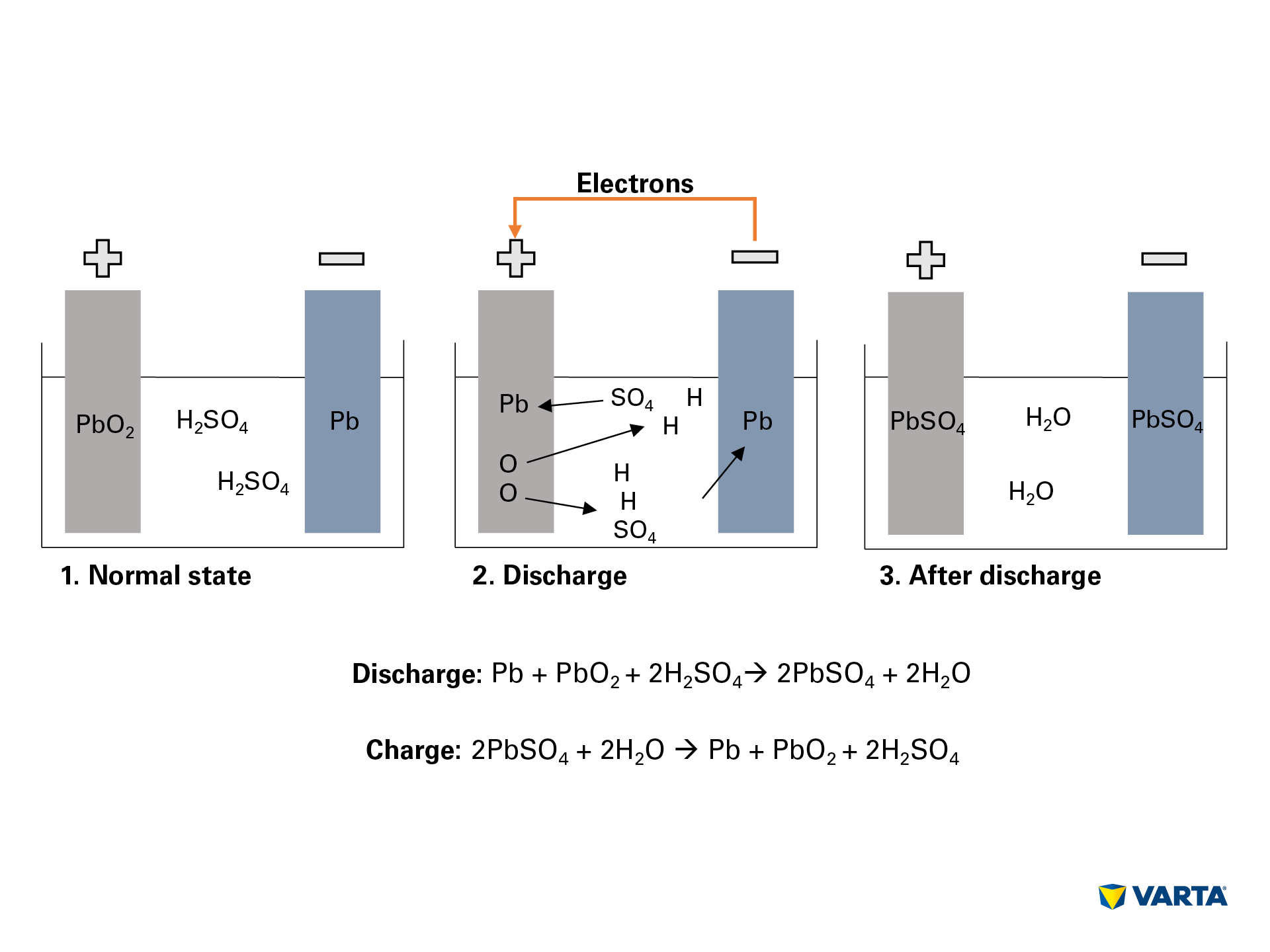
Een autobatterij slaat energie op in chemische vorm en zet deze om in elektrische energie. In dit elektro-chemische proces reageren vier materialen met elkaar:
- Waterstof (H)
- Zuurstof (O2)
- Lood (Pb)
- Zwavel (S)
Aansluiting van een externe verbruiker brengt de chemische reactie in de batterij op gang:
- De elektrolyt, een mengsel van zwavelzuur (H2SO4) en gedestilleerd water, valt uiteen in positief geladen waterstofionen (H+) en negatief geladen sulfaationen (SO42-).
- Tegelijkertijd reizen elektronen (2e-) van de negatieve naar de positieve elektrode via de externe verbruiker.
- Om deze elektronenstroom te compenseren, reizen sulfaationen van de elektrolyt naar de negatieve elektrode, waar ze met het lood (Pb) reageren tot loodsulfaat (PbSO4).
- Loodsulfaat wordt ook geproduceerd in de positieve elektrode: De binding van zuurstof (O2) in het loodoxide (PbO2) wordt verbroken door de overdracht van elektronen en de zuurstof gaat over in de elektrolyt. Het overblijvende lood (Pb) bindt zich met het sulfaat (SO4) uit de elektrolyt.
- Daar bindt de zuurstof zich met de waterstof om water (H2O) te vormen. Naarmate het zwavelzuur door de vorming van loodsulfaat wordt opgebruikt, daalt de concentratie van de elektrolytoplossing. Wanneer de concentratie van het zwavelzuur onder een bepaald niveau daalt, moet de batterij worden bijgeladen.
- Tijdens het opladen vinden de chemische processen in omgekeerde volgorde plaats. Aan het eind zijn de oorspronkelijke elementen terug te vinden: De positieve elektrode bestaat uit loodsulfaat (PbSO4), de negatieve elektrode bestaat uit zuiver lood (Pb) en de elektrolyt bestaat uit verdund zwavelzuur (H2SO4). Aangezien dit omzettingsproces gepaard gaat met verliezen, kan een batterij slechts een beperkt aantal laadcycli doorstaan. De nuttige levensduur is dus beperkt.
Problemen met lood-zuur-batterijen: Sulfatering en zuurlagen
Als een accu met een te lage spanning wordt geladen, of als de accu altijd met een te lage spanning werkt (minder dan 80%), treedt zuurlaagvorming op, ook wel stratificatie genoemd. Het zuur in de elektrolyt stratificeert als gevolg van slechte menging. Verschillende dichtheden veroorzaken gelaagdheid van het zwavelzuur op de bodem en water in het bovenste gedeelte van de batterij. Hierdoor kan alleen het middelste deel van de elektrolyt, d.w.z. slechts een derde, voor het ontladings- en oplaadproces worden gebruikt.
Een mogelijke oorzaak van de vorming van zuurlagen zijn vooral korte ritten met gelijktijdig gebruik van een groot aantal elektrische verbruikers. In dit geval heeft de dynamo niet genoeg tijd om de accu op te laden. 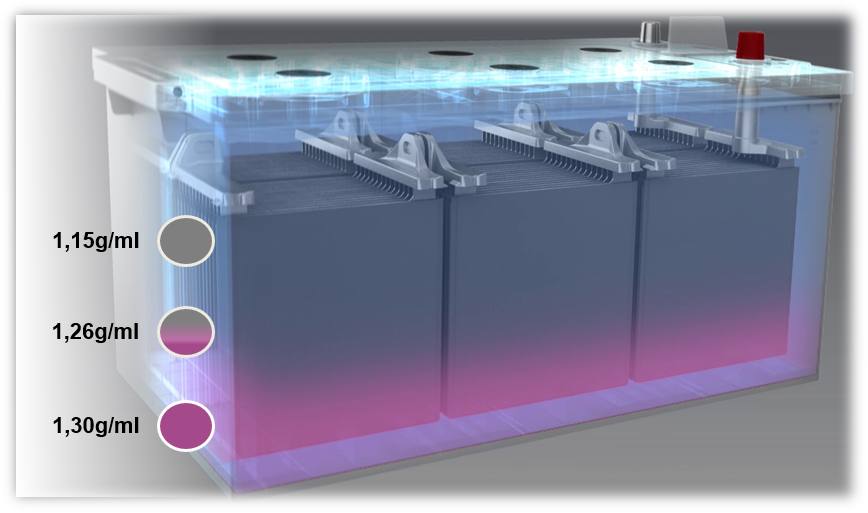
Een gevolg van de vorming van zuurlagen is sulfatering. Als dit zich voordoet in de accu, of als deze niet constant wordt opgeladen tot een adequaat niveau, kristalliseert het loodsulfaat (PbSO4) op de elektroden, om na verloop van tijd grotere kristalstructuren te vormen. Dit proces staat bekend als “sulfatatie”. De kristallisatie verhindert de omzetting van loodsulfaat in de oorspronkelijke componenten lood of loodoxide, wat resulteert in het verhinderen van de ladingsaanvaarding en een vermindering van het koudstartvermogen.
De scherpe kristallen kunnen ook de separatoren beschadigen of kortsluiting in de cellen veroorzaken.
Om dit effect tegen te gaan en voortijdige uitval van de batterij te voorkomen, mag een batterij nooit gedurende een lange periode aan een laag laadniveau worden blootgesteld. Daarom is het raadzaam de accu regelmatig te testen en zo nodig volledig op te laden.
Wilt u meer weten over dit onderwerp? Hoe laadt u een accu goed op.
Nieuwe accutechnologieën: AGM en lithium-ion
Tot nu toe hadden conventionele loodzuur-batterijen een groot marktaandeel. De markt verandert echter snel: Innovatieve batterijtechnologieën voor start-stop-voertuigen, zoals AGM, maken gebruik van zuur dat in een mat is gebonden om een grotere cyclusstabiliteit te bieden en betrouwbare prestaties te garanderen in voertuigen met hogere energie-eisen. Een ander voordeel van AGM: gelaagd zuur is niet langer mogelijk door het gebonden zuur.
Een nieuwe generatie autoaccu’s voor microhybride voertuigen werkt op 48V en gebruikt cellen met lithium-ion-technologie.