10.13: Ipotesi di Avogadro e volume molare
Ipotesi di Avogadro e volume molare
Il volume è un terzo modo per misurare la quantità di materia, dopo il numero di elementi e la massa. Con i liquidi e i solidi, il volume varia molto a seconda della densità della sostanza. Questo perché le particelle solide e liquide sono impacchettate vicine, con pochissimo spazio tra le particelle. Tuttavia, i gas sono in gran parte composti da spazi vuoti tra le particelle di gas vere e proprie (vedi figura sotto).
Nel 1811, Amadeo Avogadro spiegò che i volumi di tutti i gas possono essere facilmente determinati. L’ipotesi di Avogadro afferma che volumi uguali di tutti i gas alla stessa temperatura e pressione contengono un numero uguale di particelle. Poiché il volume totale che un gas occupa è costituito principalmente dallo spazio vuoto tra le particelle, la dimensione effettiva delle particelle stesse è quasi trascurabile. Un dato volume di un gas con piccole particelle leggere come l’idrogeno \(\sinistra( \ce{H_2} \destra)\ contiene lo stesso numero di particelle dello stesso volume di un gas pesante con grandi particelle come l’esafluoruro di zolfo, \(\ce{SF_6}\).
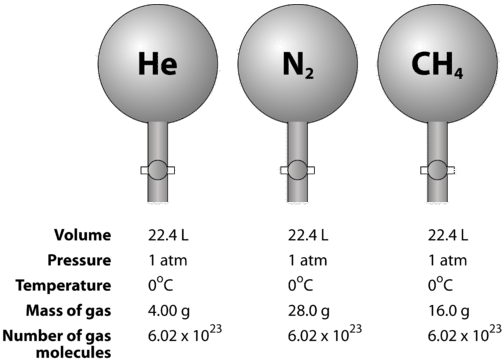
I gas sono comprimibili, il che significa che quando sono messi sotto alta pressione, le particelle sono forzate più vicine le une alle altre. Questo diminuisce la quantità di spazio vuoto e riduce il volume del gas. Il volume del gas è anche influenzato dalla temperatura. Quando un gas viene riscaldato, le sue molecole si muovono più velocemente e il gas si espande. A causa della variazione del volume del gas dovuta ai cambiamenti di pressione e temperatura, il confronto dei volumi di gas deve essere fatto a una temperatura e pressione standard. La temperatura e la pressione standard (STP) è definita come \(0^text{o} \text{C}) \(\sinistra( 273.15 \: \text{K} right)\) e \(1 \text{atm}) pressione. Il volume molare di un gas è il volume di una mole di un gas a STP. A STP, una mole (6,02 volte 10^{23}\particelle rappresentative) di qualsiasi gas occupa un volume di \(22,4 \: \text{L}\ (figura sotto).

La figura sottostante illustra come il volume molare può essere visto quando si confrontano diversi gas. Campioni di elio \(\sinistra( \ce{He} destra)\), azoto \(\sinistra( \ce{N_2} destra)\), e metano \(\sinistra( \ce{CH_4} destra)\ sono a STP. Ognuno contiene 1 mole o \(6,02 \volte 10^{23}} particelle. Tuttavia, la massa di ogni gas è diversa e corrisponde alla massa molare di quel gas: \4.00 \testo{g/mol} per \cece{He}, \28.0 \testo{g/mol} per \ce{N_2}, e \16.0 \testo{g/mol} per \ce{CH_4}.