19.1: Polypeptides and Proteins
Learning Objectives
- Define or describe the following:
- amino acid
- “R” group
- peptide bond
- peptide
- polypeptide
- primary protein structure
- secondary protein structure
- tertiary protein structure
- quaternary protein structure
- gene
- Describe how the primary structure of a protein or polypeptide ultimately detemines its final three-dimensional shape.
- Describe how the order of nucleotide bases in DNA ultimately determines the final three-dimensional shape of a protein or polypeptide.
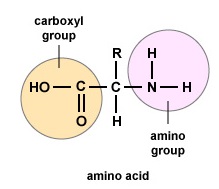
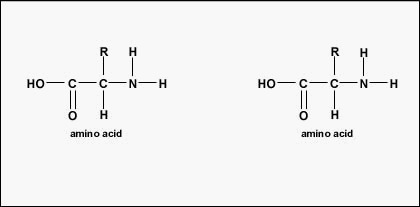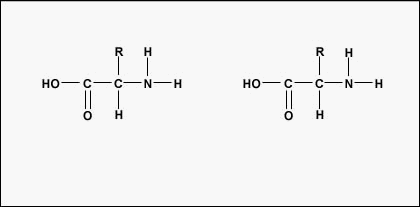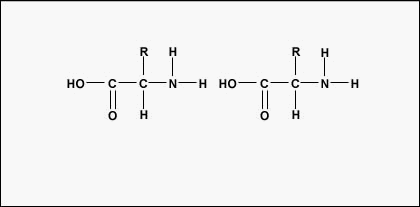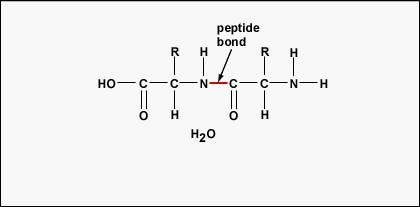
Amino acids are the building blocks for proteins. All amino acids contain an amino or NH2 group and a carboxyl (acid) or COOH group. There are 20 different amino acids commonly found in proteins and often 300 or more amino acids per protein molecule. Ogni aminoacido differisce in termini del suo gruppo “R”. Il gruppo “R” di un aminoacido è il resto della molecola, cioè la parte diversa dal gruppo amminico, dal gruppo acido e dal carbonio centrale. Ogni diverso aminoacido ha un unico gruppo “R” e le proprietà chimiche uniche di un aminoacido dipendono da quelle del suo gruppo “R” (Figura \(\PageIndex{1}}).
Per formare polipeptidi e proteine, gli amminoacidi sono uniti da legami peptidici, in cui l’ammino o NH2 di un amminoacido si lega al gruppo carbossilico (acido) o COOH di un altro amminoacido come mostrato in (Figura \PageIndex{2}} e Figura \PageIndex{3}).
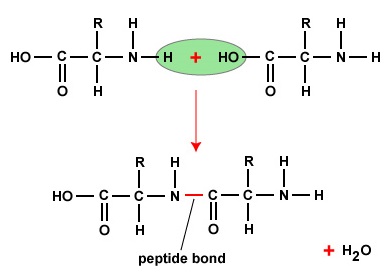
Un peptide è costituito da due o più aminoacidi uniti da legami peptidici, e un polipeptide è una catena di molti aminoacidi. Una proteina contiene uno o più polipeptidi. Pertanto, le proteine sono lunghe catene di amminoacidi tenuti insieme da legami peptidici.
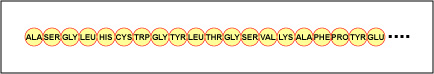
L’ordine effettivo degli aminoacidi nella proteina è chiamato struttura primaria (Figura \(\PageIndex{4}}) ed è determinato dal DNA. Come vedremo più avanti in questa unità, il DNA è diviso in unità funzionali chiamate geni. Un gene è una sequenza di basi deossiribonucleotidiche lungo un filamento di DNA che codifica per un prodotto funzionale – una specifica molecola di RNA messaggero, RNA transfer, o RNA ribosomiale. Il prodotto è di solito l’RNA messaggero (mRNA) e l’mRNA alla fine porta alla sintesi di un polipeptide o di una proteina. Pertanto, si dice comunemente che l’ordine delle basi deossiribonucleotidiche in un gene determina la sequenza di aminoacidi di una particolare proteina. Poiché alcuni aminoacidi possono interagire con altri aminoacidi nella stessa proteina, questa struttura primaria determina in ultima analisi la forma finale e quindi le proprietà chimiche e fisiche della proteina.
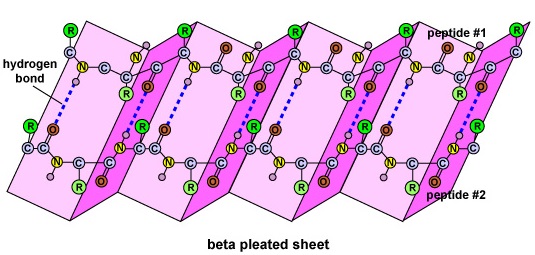
La struttura secondaria della proteina è dovuta ai legami idrogeno che si formano tra l’atomo di ossigeno di un amminoacido e l’atomo di azoto di un altro. Questo dà alla proteina o al polipeptide la forma bidimensionale di un’alfa-elica o di un foglio beta-pleato (Figura \PageIndex{5}}).
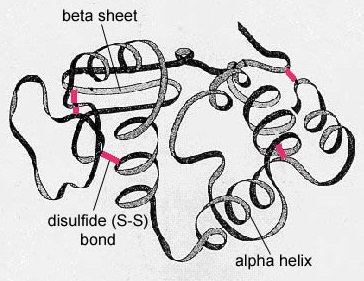
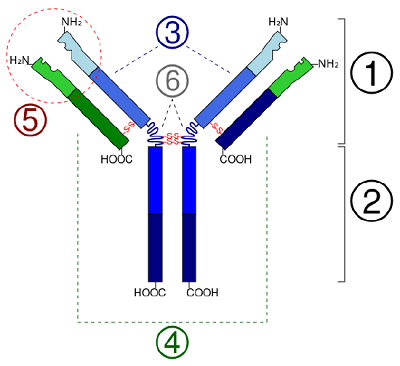
Nelle proteine globulari come gli enzimi, la lunga catena di aminoacidi si ripiega in una forma funzionale tridimensionale o struttura terziaria. Questo perché alcuni amminoacidi con gruppi sulfidrilici o SH formano legami disolfuro (S-S) con altri amminoacidi della stessa catena. Anche altre interazioni tra i gruppi R degli aminoacidi, come i legami idrogeno, i legami ionici, i legami covalenti e le interazioni idrofobiche contribuiscono alla struttura terziaria (Figura \(\PageIndex{6})). In alcune proteine, come le molecole di anticorpi e l’emoglobina, diversi polipeptidi possono legarsi insieme per formare una struttura quaternaria (Figura \PageIndex{7}).
Come si vedrà più avanti in questa unità, durante la sintesi proteica, l’ordine delle basi nucleotidiche lungo un gene viene trascritto in un filamento complementare di mRNA che viene poi tradotto dal tRNA nel corretto ordine degli aminoacidi per quel polipeptide o proteina. Pertanto, l’ordine delle basi deossiribonucleotidiche lungo il DNA determina l’ordine degli amminoacidi nelle proteine. Poiché alcuni aminoacidi possono interagire con altri aminoacidi, l’ordine degli aminoacidi per ogni proteina determina la sua forma tridimensionale finale, che a sua volta determina la funzione di quella proteina (ad es, con quale substrato reagirà un enzima, con quali epitopi si combinerà la Fab di un anticorpo, a quali recettori si legherà una citochina).
Sommario
- Gli aminoacidi sono i mattoni delle proteine. Ci sono 20 diversi aminoacidi che si trovano comunemente nelle proteine e spesso 300 o più aminoacidi per molecola proteica.
- Tutti gli aminoacidi contengono un gruppo amminico o NH2 e un gruppo carbossilico (acido) o COOH.
- Per formare polipeptidi e proteine, gli amminoacidi sono uniti da legami peptidici, in cui l’ammino o NH2 di un amminoacido si lega al gruppo carbossilico (acido) o COOH di un altro amminoacido.
- Un peptide è costituito da due o più amminoacidi uniti da legami peptidici; un polipeptide è una catena di molti amminoacidi; e una proteina contiene uno o più polipeptidi. Quindi, le proteine sono lunghe catene di amminoacidi tenuti insieme da legami peptidici.
- L’ordine effettivo degli amminoacidi nella proteina è chiamato struttura primaria ed è determinato dal DNA.
- L’ordine delle basi deossiribonucleotidiche in un gene determina la sequenza di amminoacidi di una particolare proteina. Poiché certi amminoacidi possono interagire con altri amminoacidi nella stessa proteina, questa struttura primaria determina alla fine la forma finale e quindi le proprietà chimiche e fisiche della proteina.
- La struttura secondaria della proteina è dovuta ai legami idrogeno che si formano tra l’atomo di ossigeno di un aminoacido e l’atomo di azoto di un altro e dà alla proteina o polipeptide la forma bidimensionale di un’alfa-elica o di un foglio pieghettato beta.
- Nelle proteine globulari come gli enzimi, la lunga catena di aminoacidi viene ripiegata in una forma funzionale tridimensionale o struttura terziaria. Questo perché alcuni amminoacidi con gruppi sulfidrilici o SH formano legami disolfuro (S-S) con altri amminoacidi della stessa catena. Anche altre interazioni tra i gruppi R degli aminoacidi come i legami idrogeno, i legami ionici, i legami covalenti e le interazioni idrofobiche contribuiscono alla struttura terziaria.
- In some proteins, such as antibody molecules, several polypeptides may bond together to form a quaternary structure.
Contributors and Attributions
-
Dr. Gary Kaiser (COMMUNITY COLLEGE OF BALTIMORE COUNTY, CATONSVILLE CAMPUS)