2.3D: Teoria della separazione
Teoria generale
La TLC è un eccellente strumento analitico per separare miscele in un campione. In questa sezione si discutono i dettagli della separazione, e si espande la discussione generale della Sezione 2.1.B.
In tutte le forme di cromatografia, i campioni si equilibrano tra le fasi stazionarie e mobili. In quasi tutte le applicazioni della TLC, la fase stazionaria è un adsorbente di silice o allumina e la fase mobile è un solvente organico o una miscela di solventi (l'”eluente”) che sale sulla piastra (equazione 3).
Gel di silice (mostrato nella figura 2.16) è composto da una rete di legami silicio-ossigeno, con legami \ce{O-H} sulla sua superficie, così come uno strato di molecole d’acqua. Il gel di silice \sinistra( \ce{SiO_2} \cdot x \ce{H_2O} \destra)\ viene usato in questa discussione, ma è strutturalmente analogo all’allumina \ce a sinistra( \ce{Al_2O_3} \cdot x \ce{H_2O} \destra)\. Questa fase stazionaria molto polare è accoppiata con una fase mobile relativamente non polare (un solvente organico o una soluzione), in quella che viene chiamata TLC a “fase normale”. Anche se questa è la forma più comune di TLC (e quella su cui ci si concentrerà in questa sezione), a volte si usa la TLC a “fase inversa” (con una fase stazionaria non polare e una fase mobile polare).
La figura 2.16 mostra come l’acetofenone si aggrapperebbe alla superficie del gel di silice attraverso le forze intermolecolari (IMF). In questo caso, l’acetofenone può legarsi a idrogeno (la FMI indicata nella figura 2.16a) alla superficie della silice attraverso il suo atomo di ossigeno. Mentre l’eluente scorre sul campione (Figura 2.16b), si stabilisce un equilibrio tra il campione adsorbito sulla fase stazionaria e dissolto nella fase mobile. Quando si trova nella fase mobile, il composto risale la piastra con il flusso del liquido (Figura 2.16c) per poi leggere sulla fase stazionaria più in alto nella piastra. La risultante \(R_f\) del composto dipende dalla quantità di tempo trascorso nelle fasi stazionaria e mobile.
.png?revision=1&size=bestfit&width=1110&height=395)
La distribuzione dell’equilibrio tra le due fasi dipende da diversi fattori:
- Dipende dalla forza delle forze intermolecolari tra il campione e la fase stazionaria.
Un composto che forma forti IMF con la silice o l’allumina spesso favorirà la fase stazionaria, e passerà molto del tempo di eluizione aderendo alla piastra. Questo significa che passerà meno tempo nella fase mobile (che è l’unico mezzo per risalire la piastra), facendolo finire in basso sulla piastra TLC, e avere un basso \(R_f\).
I composti che hanno atomi di ossigeno o azoto dovrebbero essere in grado di legarsi a idrogeno con la fase stazionaria (avere una forte IMF con la fase stazionaria), e quindi avranno valori di \(R_f\) più bassi dei composti di dimensioni simili che possono interagire solo attraverso le forze di dispersione di Londra (LDF). - Dipende dalla forza di interazione tra il campione e la fase mobile.
Poiché la fase mobile è sempre meno polare della fase stazionaria nella TLC in fase normale, i composti polari tenderanno ad avere un’affinità minore per la fase mobile rispetto ai composti non polari (in base al principio “il simile si scioglie come”). Pertanto, i composti polari tendono a trascorrere meno del tempo di eluizione mobile di un composto non polare, quindi viaggeranno “più lentamente” su per la piastra, e hanno un basso \(R_f\).
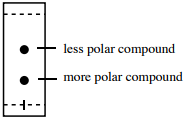
Il grado di attrazione di un composto verso le fasi stazionarie e mobili portano alla stessa conclusione:
- Più forte è la FMI possibile con la fase stazionaria (spesso i gruppi funzionali più polari su un composto), più tempo il composto sarà stazionario \(R_f\) inferiore.
- Più gruppi funzionali polari presenti su un composto, meno tende ad essere attratto dall’eluente meno polare, e meno tempo il composto sarà mobile \(\freccia destra) più basso \(R_f\).
Quindi, un composto con un \(R_f\) più basso tende ad avere più gruppi funzionali polari di un composto con un \(R_f\) più alto (riassunto in figura 2.17).