4. Basi forti e deboli
Basi deboli
L’ammoniaca è una tipica base debole. L’ammoniaca stessa ovviamente non contiene ioni idrossido, ma reagisce con l’acqua per produrre ioni ammonio e ioni idrossido.
Tuttavia, la reazione è reversibile, e in qualsiasi momento circa il 99% dell’ammoniaca è ancora presente come molecole di ammoniaca. Solo l’1% circa ha effettivamente prodotto ioni idrossido. Una base debole è quella che non si converte completamente in ioni idrossido in soluzione. Quando una base debole reagisce con l’acqua, la posizione dell’equilibrio varia da base a base. Più a sinistra è, più la base è debole.
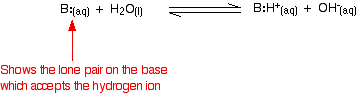
Puoi ottenere una misura della posizione di equilibrio scrivendo una costante di equilibrio per la reazione. Più basso è il valore della costante, più l’equilibrio si trova a sinistra. In questo caso la costante di equilibrio si chiama Kb. Questa è definita come:
\}{}\]
The relationship between Kb and pKb is exactly the same as all the other “p” terms in this topic:
\
The table shows some values for \(K_b\) and \(pK_b\) for some weak bases.
| base | Kb (mol dm-3) | pKb |
|---|---|---|
| C6H5NH2 | 4.17 x 10-10 | 9.38 |
| NH3 | 1.78 x 10-5 | 4.75 |
| CH3NH2 | 4.37 x 10-4 | 3.36 |
| CH3CH2NH2 | 5.37 x 10-4 | 3.27 |