Adipociti
Gli adipociti sono i principali siti di stoccaggio di energia nel corpo, e hanno anche funzioni endocrine critiche. Pertanto, comprendere lo sviluppo e la funzione degli adipociti – in particolare alla luce della pandemia di obesità – è essenziale per comprendere l’omeostasi metabolica. Ci sono due classi generali di adipociti; adipociti bianchi – che immagazzinano energia come una singola goccia lipidica di grandi dimensioni e hanno importanti funzioni endocrine, e adipociti bruni – che immagazzinano energia in più goccioline lipidiche ma specificamente per l’uso come combustibile per generare calore corporeo (cioè termogenesi). La produzione di calore da parte degli adipociti bruni è resa possibile dalla loro unica espressione della proteina disaccoppiante 1 (Ucp1) localizzata nel mitocondrio. Tuttavia, queste classificazioni sono eccessivamente semplificate perché alcuni adipociti bianchi possono adottare caratteristiche di adipociti bruni (chiamati adipociti bruni o beige) e viceversa a seconda della temperatura e della dieta. Siamo interessati a capire le origini dei diversi adipociti e a definire le vie di segnalazione e metaboliche che controllano il loro sviluppo, distribuzione e funzione.
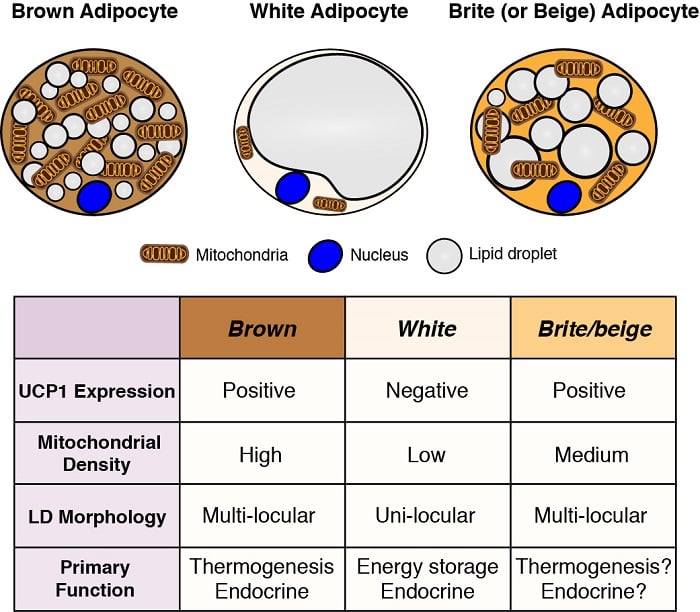
Le origini degli adipociti
Per comprendere il ruolo del tessuto adiposo nella salute e nella malattia è fondamentale capire come cresce, e a questo proposito, una delle aree meno comprese della biologia del tessuto adiposo è l’origine dello sviluppo dei diversi tipi di adipociti. Definire le origini degli adipociti potrebbe aiutare a spiegare i modelli di distribuzione del grasso corporeo umano, in particolare negli individui obesi o lipodistrofici, e potrebbe fornire indizi sulle differenze metaboliche osservate tra alcuni depositi di grasso. Identificare le cellule precursori degli adipociti e i meccanismi che regolano la loro espansione è anche fondamentale per comprendere e gestire la funzione del tessuto adiposo sano. Potrebbe anche essere possibile ingegnerizzare lo sviluppo di adipociti “sani” (come gli adipociti bruni o bruno/beige) da precursori per terapie basate su cellule volte essenzialmente a combattere il grasso con il grasso. Utilizzando una combinazione di genetica e strategie di lineage-tracing abbiamo precedentemente mappato le origini degli adipociti che risiedono in diversi depositi. I nostri risultati rivelano un livello inaspettato di eterogeneità coerente con gli adipociti che hanno origini di sviluppo multiple e che supportano un modello in cui il destino degli adipociti dipende probabilmente da fattori sia estrinseci che intrinseci.
Gli adipociti hanno origini di sviluppo multiple
(sotto a sinistra) Distribuzione anatomica dei depositi di tessuto adiposo in un topo. Sono mostrati i depositi di tessuto adiposo bruno (BAT) e di tessuto adiposo bianco (WAT). (sotto a destra) Un esempio di un esperimento di lineage tracing durante il quale le cellule precursori dello sviluppo e tutti i loro decendenti sono stati etichettati indelebilmente con un marchio fluorescente legato all’espressione di Myf5 (pannello a) o Pax3 (pannello b). Gli adipociti etichettati in verde (mGFP) provengono da una cellula precursore diversa dagli adipociti etichettati in rosso (mTFP).
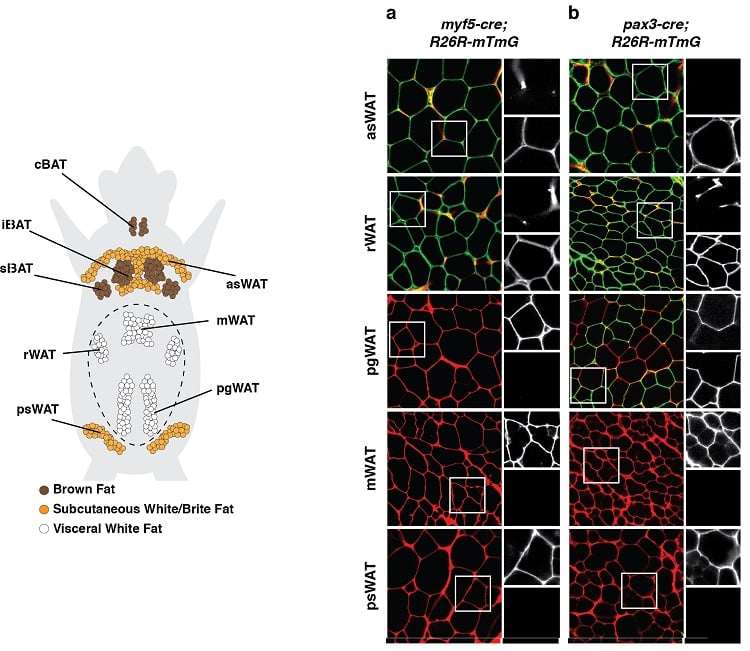
Risultati come questi suggeriscono che gli adipociti hanno origini di sviluppo multiple.
(adattato da Sanchez-Gurmaches & Guertin, Nature Communications 2014; Sanchez-Gurmaches et al., Trends in Cell Biology 2016)
Adipociti bruni
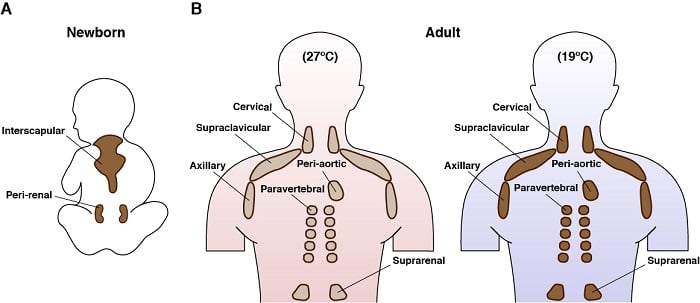
Gli adipociti bruni sono cellule affascinanti. Esistono solo nei mammiferi, e la loro funzione principale è quella di generare calore endogeno in un processo chiamato termogenesi. Questo è reso possibile dalla loro unica espressione di una proteina di membrana mitocondriale chiamata proteina disaccoppiante 1 (UCP1). Le proprietà di consumo energetico del grasso bruno, e la recente realizzazione che gli esseri umani adulti hanno grasso bruno, li ha resi un bersaglio per le terapie volte a combattere la sovranutrizione. Gli adipociti bruni attivi hanno anche uno dei programmi metabolici più intriganti: assumono e consumano grandi quantità di diversi nutrienti simultaneamente (ad esempio, glucosio, lipidi, aminoacidi) e possono impegnare contemporaneamente sia il metabolismo anabolico che quello catabolico. Per esempio, noi e altri hanno mostrato in precedenza che il BAT stimolato a freddo regola ampiamente un programma genetico che supporta le vie di sintesi dei lipidi de novo oltre alle vie di ossidazione degli acidi grassi. Vorremmo capire di più su questo notevole e paradossale metabolismo.
Scopri di più sullo sviluppo e il metabolismo del tessuto adiposo bruno
Localizzazione anatomica del grasso bruno nell’uomo
Utilizziamo anche modelli genetici per studiare come i percorsi di segnalazione controllano il metabolismo del BAT. Per esempio, usando i topi abbiamo geneticamente eliminato Rictor – che codifica un componente unico ed essenziale di mTORC2 – solo nel tessuto adiposo marrone. Per saperne di più su mTORC2. Notevolmente, questi topi sono protetti da una dieta ad alto contenuto di grassi. Più specificamente, i topi privi di BAT Rictor non hanno accumulato lipidi eccessivi nel loro fegato o nei depositi di tessuto adiposo viscerale quando mangiavano la dieta ad alto contenuto di grassi. Questa è una scoperta entusiasmante, poiché l’accumulo di lipidi in eccesso in questi siti è pericolosamente malsano. Utilizzando una combinazione di genetica, genomica, metabolomica e biochimica, stiamo cercando di capire perché questi topi sono protetti dalla dieta ad alto contenuto di grassi.
Adipociti bianchi
Gli adipociti bianchi sono i più abbondanti nell’uomo. I depositi di tessuto adiposo bianco hanno anche una notevole capacità di espandersi e immagazzinare energia, e segnalano al cervello e ad altri tessuti per influenzare fortemente il comportamento alimentare e l’omeostasi metabolica. Tuttavia, mentre gli adipociti bianchi sono specificamente adattati per rinchiudere in modo sicuro i nutrienti in eccesso, hanno un punto di svolta (ad esempio nell’obesità) in cui le loro funzioni benefiche falliscono, e questo promuove fortemente l’insorgenza della malattia metabolica e del diabete di tipo 2. Cosa definisce il punto di ribaltamento? Come segnalano gli adipociti bianchi agli altri tessuti? Quanto sono eterogenei i depositi di tessuto adiposo bianco? Perché avere un eccesso di grasso viscerale è più dannoso per la salute che avere un eccesso di grasso sottocutaneo? Queste sono tutte domande in sospeso che ci interessano.
Stiamo anche studiando la segnalazione mTOR negli adipociti bianchi. mTOR è un importante bersaglio a valle della segnalazione dell’insulina, che è il principale ormone a cui rispondono gli adipociti. Utilizzando modelli di topi genetici, abbiamo inibito selettivamente mTORC1 o mTORC2 in tutti gli adipociti. L’inibizione di mTORC1 nel tessuto adiposo bianco causa una sindrome simile alla lipodistrofia, associata a resistenza all’insulina e malattia del fegato grasso. Inibire mTORC2 nel tessuto adiposo bianco causa anche l’insulino-resistenza, ma indipendentemente dai cambiamenti nella massa del tessuto adiposo. In quest’ultimo modello, mTORC2 sembra regolare un segnale derivato dagli adipociti che comunica con il fegato per controllare la produzione epatica di glucosio. Comprendere la base meccanicistica di questi fenotipi fornirà informazioni critiche su come le vie di trasduzione del segnale di rilevamento dei nutrienti contribuiscono alla patogenesi delle malattie legate al tessuto adiposo.
Modello di segnalazione mTORC2 in un adipocita bianco
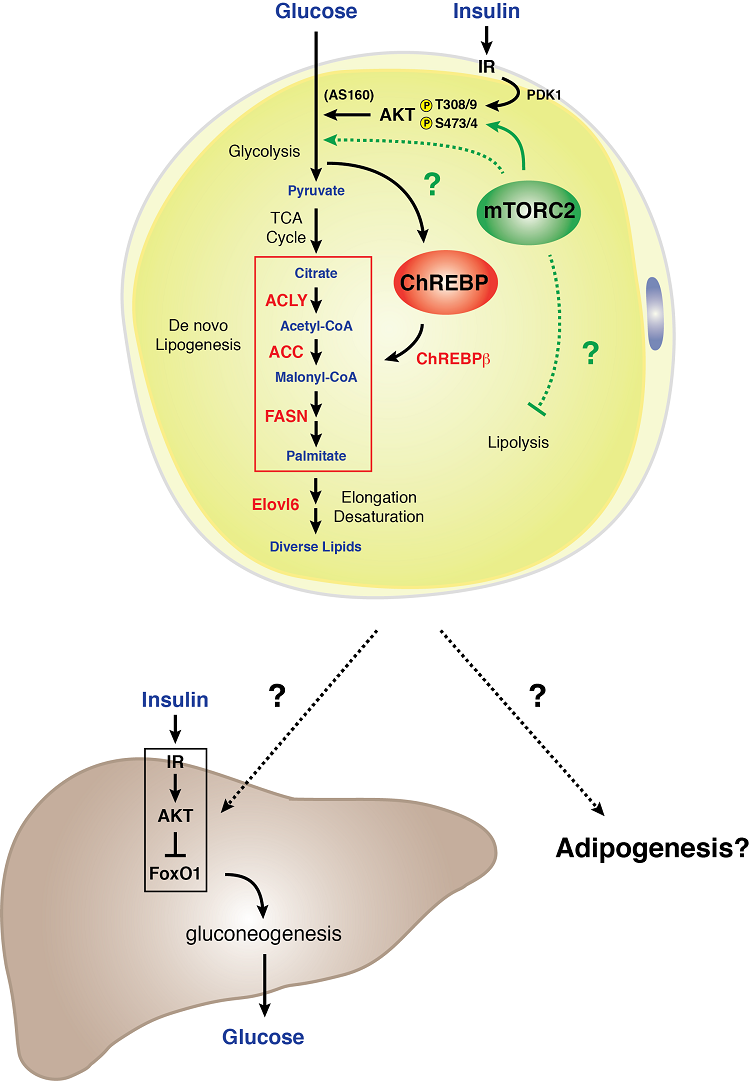 Gli adipociti bianchi richiedono mTORC2 per il normale metabolismo di carboidrati e lipidi. Abbiamo scoperto che la perdita genetica di Rictor (mTORC2) specificamente negli adipociti bianchi riduce l’assorbimento del glucosio e attenua l’espressione del fattore di trascrizione ChREBP-beta e i suoi obiettivi a valle – che comprende gli enzimi che funzionano nel percorso di lipogenesi de novo. Inoltre, una carenza di mTORC2 nelle cellule adipose bianche provoca una grave insulino-resistenza epatica. Questi dati indicano che mTORC2 degli adipociti bianchi è un regolatore essenziale del metabolismo dei carboidrati e dei lipidi ed è un componente chiave di un meccanismo di comunicazione extra-epatico dell’organo sensibile ai nutrienti che controlla l’omeostasi sistemica del glucosio. Comprendere la biologia della segnalazione mTORC2 nel grasso bianco può tenere indizi importanti per come il tessuto adiposo bianco funziona come un organo di rilevamento del glucosio e mediatore del fitness metabolico sistemico.
Gli adipociti bianchi richiedono mTORC2 per il normale metabolismo di carboidrati e lipidi. Abbiamo scoperto che la perdita genetica di Rictor (mTORC2) specificamente negli adipociti bianchi riduce l’assorbimento del glucosio e attenua l’espressione del fattore di trascrizione ChREBP-beta e i suoi obiettivi a valle – che comprende gli enzimi che funzionano nel percorso di lipogenesi de novo. Inoltre, una carenza di mTORC2 nelle cellule adipose bianche provoca una grave insulino-resistenza epatica. Questi dati indicano che mTORC2 degli adipociti bianchi è un regolatore essenziale del metabolismo dei carboidrati e dei lipidi ed è un componente chiave di un meccanismo di comunicazione extra-epatico dell’organo sensibile ai nutrienti che controlla l’omeostasi sistemica del glucosio. Comprendere la biologia della segnalazione mTORC2 nel grasso bianco può tenere indizi importanti per come il tessuto adiposo bianco funziona come un organo di rilevamento del glucosio e mediatore del fitness metabolico sistemico.