Chimica per non-magistrati
Obiettivi di apprendimento
- Definire il raggio atomico.
- Descrivere come cambia l’atomo in un periodo.
- Descrivere come cambia il raggio atomico all’interno di un gruppo.
Come fanno tutte queste persone a stare in uno spazio così piccolo?
 Gli eventi attirano un gran numero di persone. Anche un evento all’aperto può riempirsi in modo che non ci sia spazio per altre persone. La capacità della folla dipende dalla quantità di spazio nel locale, e la quantità di spazio dipende dalla dimensione degli oggetti che lo riempiono. Possiamo far entrare più persone in un dato spazio che elefanti, perché gli elefanti sono più grandi delle persone. Possiamo far entrare più scoiattoli in quello stesso spazio che persone per lo stesso motivo. Conoscere le dimensioni degli oggetti con cui abbiamo a che fare può essere importante per decidere quanto spazio è necessario.
Gli eventi attirano un gran numero di persone. Anche un evento all’aperto può riempirsi in modo che non ci sia spazio per altre persone. La capacità della folla dipende dalla quantità di spazio nel locale, e la quantità di spazio dipende dalla dimensione degli oggetti che lo riempiono. Possiamo far entrare più persone in un dato spazio che elefanti, perché gli elefanti sono più grandi delle persone. Possiamo far entrare più scoiattoli in quello stesso spazio che persone per lo stesso motivo. Conoscere le dimensioni degli oggetti con cui abbiamo a che fare può essere importante per decidere quanto spazio è necessario.
Le dimensioni degli atomi sono importanti quando si cerca di spiegare il comportamento degli atomi o dei composti. Uno dei modi in cui possiamo esprimere le dimensioni degli atomi è il raggio atomico. Questi dati ci aiutano a capire perché alcune molecole stanno bene insieme e perché altre molecole hanno parti che diventano troppo affollate in certe condizioni.
La dimensione di un atomo è definita dal bordo del suo orbitale. Tuttavia, i confini orbitali sono confusi e infatti sono variabili in condizioni diverse. Per standardizzare la misura dei raggi atomici, si misura la distanza tra i nuclei di due atomi identici legati insieme. Il raggio atomico è definito come la metà della distanza tra i nuclei di atomi identici legati insieme.

Figura 1. Il raggio atomico (r) di un atomo può essere definito come la metà della distanza (d) tra due nuclei in una molecola biatomica.
I raggi atomici sono stati misurati per gli elementi. Le unità per i raggi atomici sono i picometri, pari a 10-12 metri. Per esempio, la distanza internucleare tra i due atomi di idrogeno in una molecola di H2 è misurata a 74 pm. Pertanto, il raggio atomico di un atomo di idrogeno è \frac{74}{2}=37\text{ pm}.
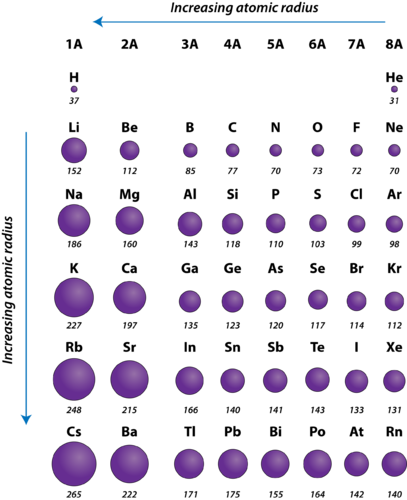
Figura 2. Raggi atomici degli elementi rappresentativi misurati in picometri.
Tendenza periodica
Il raggio atomico degli atomi generalmente diminuisce da sinistra a destra attraverso un periodo. Ci sono alcune piccole eccezioni, come il raggio dell’ossigeno che è leggermente più grande del raggio dell’azoto. All’interno di un periodo, i protoni vengono aggiunti al nucleo mentre gli elettroni vengono aggiunti allo stesso livello energetico principale. Questi elettroni vengono gradualmente avvicinati al nucleo a causa della sua maggiore carica positiva. Poiché la forza di attrazione tra nuclei ed elettroni aumenta, la dimensione degli atomi diminuisce. L’effetto diminuisce man mano che ci si sposta più a destra in un periodo a causa delle repulsioni elettrone-elettrone che altrimenti farebbero aumentare le dimensioni dell’atomo.
Tendenza dei gruppi
Il raggio atomico degli atomi generalmente aumenta dall’alto verso il basso all’interno di un gruppo. Come il numero atomico aumenta verso il basso di un gruppo, c’è di nuovo un aumento della carica nucleare positiva. Tuttavia, c’è anche un aumento del numero di livelli energetici principali occupati. I livelli energetici principali più alti consistono in orbitali di dimensioni maggiori rispetto agli orbitali dei livelli energetici inferiori. L’effetto del maggior numero di livelli energetici principali supera l’aumento della carica nucleare e quindi il raggio atomico aumenta lungo un gruppo.

Figura 3. A graph of atomic radius plotted versus atomic number. Each successive period is shown in a different color. As the atomic number increases within a period, the atomic radius decreases.
Summary
- Atomic radius is determined as the distance between the nuclei of two identical atoms bonded together.
- The atomic radius of atoms generally decreases from left to right across a period.
- The atomic radius of atoms generally increases from top to bottom within a group.
Practice
Use the link below to answer the following questions:
http://chemwiki.ucdavis.edu/Inorganic_Chemistry/Descriptive_Chemistry/Periodic_Table_of_the_Elements/Atomic_Radi
- What influences the atomic size of an atom?
- What is a covalent radius?
- What is an ionic radius?
Review
- Define “atomic radius.”
- What are the units for measurement of atomic radius?
- How does the atomic radius change across a period?
- How does atomic radius change from top to bottom within a group?
- Explain why the atomic radius of hydrogen is so much smaller that the atomic radius for potassium.