Classificazione della gravità della malattia polmonare cronica ostruttiva secondo le nuove linee guida 2011 dell’Iniziativa Globale per la malattia polmonare cronica ostruttiva: COPD Assessment Test Versus Modified Medical Research Council Scale | Archivos de Bronconeumología
Introduzione
La broncopneumopatia cronica ostruttiva (BPCO) colpisce il 9,1% della popolazione adulta spagnola di età compresa tra i 40 e i 69 anni ed è una delle principali cause di morte per malattie non trasmissibili a livello mondiale.1,2 Le linee guida per la gestione della BPCO specificano che la diagnosi deve includere la spirometria. Questo test classifica la gravità della malattia in base alla percentuale di FEV1 rispetto al valore predetto (FEV1%), e la strategia di trattamento viene definita di conseguenza.3,4 Tuttavia, questa procedura è relativamente poco correlata alla mortalità e alla sintomatologia del paziente.5 Una valutazione multidimensionale che incorpora non solo la funzione polmonare ma anche la quantificazione dei sintomi (ad esempio le scale di dispnea), lo stato nutrizionale del paziente e la capacità di esercizio, come l’indice BODE,6 ha contribuito a un cambiamento nella percezione di questa malattia.7
La revisione della Global Initiative for Chronic Obstructive Lung Disease (GOLD 2011) propone che i pazienti siano stratificati in base alla gravità della malattia, con l’incorporazione dei sintomi determinati con la scala modificata del Medical Research Council (mMRC) o lo stato di salute utilizzando il COPD Assessment Test (CAT), così come la storia di esacerbazioni del paziente e il FEV1% post-broncodilatatore (pb).8 I pazienti sono classificati in base al rischio: basso rischio (pbFEV1%≥50% o 1
% meno sintomi (CAT10 o mMRC 0-1) o più sintomi (CAT≥10 o mMRC≥2). Così, si identificano quattro categorie: A (basso rischio, meno sintomi), B (basso rischio, più sintomi), C (alto rischio, meno sintomi), D (alto rischio, più sintomi). L’approccio terapeutico proposto è diverso per ogni gruppo8 (Fig. 1).
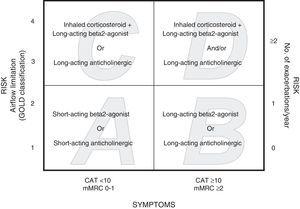
GOLD 2011 categorie e trattamento farmacologico (prima raccomandazione) per ogni categoria.
Lo scopo di questo studio è stato quello di determinare da una coorte di studio osservazionale (BODE Center, Saragozza, Spagna) se la scelta di una scala di sintomi (mMRC) o un questionario che misura la qualità della vita (CAT) origina differenze nell’assegnazione alle varie categorie di gravità e le corrispondenti implicazioni terapeutiche.
Pazienti e metodiDisegno dello studio
Il progetto BODE è uno studio osservazionale multicentrico per valutare la storia naturale della BPCO. I pazienti sono stati inizialmente selezionati tra il 1996 e il 2000 e sono stati seguiti su base annuale. Il protocollo e i principali risultati sanitari sono stati descritti in precedenza.6 La diagnosi di BPCO è stata stabilita secondo i criteri GOLD8: pbFEV1%/FVC%20 pack-years. Tra gennaio 2010 e settembre 2012, 283 nuovi pazienti sono stati valutati nel nostro centro, e quest’ultimo gruppo di studio è stato utilizzato per questa analisi.
Procedure
Le misurazioni standardizzate nella coorte BODE includevano dati demografici, cartelle cliniche e questionari sulla salute e la qualità della vita, compresi il CAT e il mMRC. Entrambe le valutazioni sono state somministrate lo stesso giorno e dallo stesso intervistatore per ogni paziente.
Il questionario CAT è uno strumento autosomministrato per valutare la qualità della vita del paziente con BPCO. Consiste di 8 item, che producono un punteggio da 0 a 40; un punteggio più alto indica uno stato di salute peggiore.9 La scala della dispnea mMRC è uno strumento che stabilisce la gravità della dispnea in relazione a vari compiti fisici. Consiste di 5 voci e viene valutata con un punteggio da 0 (nessuna dispnea o solo con sforzo) a 4 (dispnea a riposo).10
La spirometria è stata eseguita prima e 20-30 minuti dopo l’inalazione di 200μg di salbutamolo secondo una procedura standardizzata.11 Tutti i pazienti hanno eseguito un test del cammino di 6 minuti.
L’assegnazione dei pazienti alle categorie GOLD 2011 è stata stabilita indipendentemente, utilizzando la scala mMRC (dispnea) e la scala CAT (qualità della vita). Le regole di stratificazione specificano che prima il paziente deve essere stratificato nei gruppi A o C quando la mMRC è 0-1 o il punteggio CAT è Fig. 1). Poi il rischio del paziente deve essere stabilito utilizzando una delle due procedure. Con una procedura, i pazienti con pbFEV1%≥50% sono assegnati alle categorie A o B (basso rischio) e i pazienti con pbFEV18 Un’esacerbazione è stata definita grave quando il paziente è stato visto al pronto soccorso o ricoverato in ospedale. I dati delle esacerbazioni precedenti sono stati ottenuti da questionari somministrati ai pazienti e dai database del sistema intranet del servizio sanitario di Aragona. Per stabilire il rischio, è stato selezionato l’indice più alto tra la limitazione del flusso d’aria misurata dal pbFEV1% e la storia delle esacerbazioni.
Analisi statistica
È stata fatta un’analisi descrittiva delle caratteristiche dei pazienti inclusi nella serie. Sono stati analizzati i dati sulle variabili demografiche e cliniche, i test di funzionalità respiratoria e i test da sforzo. La coorte di pazienti è stata classificata in quattro categorie, secondo i criteri GOLD 2011 (A, B, C e D), utilizzando il questionario CTA e, in alternativa, la scala mMRC. Il grado di concordanza tra i risultati ottenuti dall’applicazione di entrambi i metodi alla stessa coorte di pazienti è stato determinato calcolando l’indice kappa ponderato (κ) (accordo o concordanza tra test diagnostici qualitativi ordinali). La correlazione di Spearman (stimatore non parametrico rho ) è stata calcolata per valutare la coerenza tra i due metodi di valutazione registrati nella scala qualitativa ordinale. Il test ANOVA è stato utilizzato per confrontare le medie delle variabili cliniche e funzionali nelle quattro categorie GOLD 2011, a seconda che uno o l’altro metodo di valutazione sia stato utilizzato per classificare i pazienti. Le analisi sono state eseguite utilizzando il software SPSS 19.0®.
Risultati
Dei 283 pazienti arruolati nello studio, 260 (92%) erano uomini e 23 (8%) donne. L’età media era di 71±12 anni. Le principali variabili demografiche, cliniche e funzionali sono mostrate nella tabella 1. La tabella 2 mostra queste variabili raggruppate per sesso con una valutazione di eventuali differenze significative tra i vari parametri analizzati. In questa visita, 70 (24,7%) pazienti erano ancora fumatori attivi. Il pbFEV1% medio era 62,4±19,9%. La Fig. 2 mostra la distribuzione dei pazienti secondo i loro valori CAT e mMRC; la correlazione è stata calcolata con il coefficiente di Spearman ρ=0,613.
Variabili demografiche, cliniche e funzionali (media±deviazione standard).
| Total | 283 patients |
| Sex | 260 (92%) males; 23 (8%) females |
| Age | 71±12 years |
| BMI | 28.5±4.8 |
| Active smoker | 70 patients (24.7%) |
| PYI | 61.8±36.77 |
| Comorbidities | HT: 152 patients (53.7%); dyslipidemia: 106 (37.5%); diabetes: 53 (18.7%); cardiovascular episodes: 124 (43.8%); no comorbidity: 48 (17%) |
| pbFEV1% | 62.4%±20.3 |
| PBD(+) | 33 patients (11.6%) |
| Baseline SatO2 | 93.9%±6.3 |
| Walking test | 389.2m±96.2 |
| Spirometry results | |
| FVC | 2.8l±0.8 |
| FVC% | 76.8%±19.8 |
| FEV1 | 1.6l±0.6 |
| FEV1% | 57.5%±19.9 |
| FEV1/FVC | 0.54±0.12 |
| FEV1/FVC% | 0.74±0.17 |
| pbFVC | 3.07l±0.86 |
| pbFVC% | 82.8%±19.25 |
| pbFEV1 | 1.7l±0.7 |
| pbFEV1% | 62.4%±20.3 |
| pbFEV1/FVC | 0.55±0.13 |
| pbFEV1/FVC % | 0.75±17.8 |
FEV1%: forced expiratory volume in one second, percentage of predicted value; FVC: forced vital capacity; HT: hypertension; BMI: body mass index; PYI: pack-year index; pb: post-bronchodilator; PBD(+): positive bronchodilator test; SatO2: oxygen saturation.
Demographic, Clinical and Functional Variables by Sex (Mean±Standard Deviation).
| Males | Females | P | |
| n | 260 (92%) | 23 (8%) | |
| Age | 71.3 years±7.5 | 64.5 years±8.6 | NS (P=.3) |
| BMI | 28.6±4.7 | 27.3±7.1 | P |
| Active smoker | 60 (23.1%) | 10 (43.5%) | P |
| PYI | 62.6±33.5 | 53.3±21 | P |
| pbFEV1% | 62.9%±20.1 | 57.5%±21.8 | NS (P |
| PBD(+) | 29 (11.1%) | 4 (17.4%) | NS (P=.36) |
| Baseline SatO2 | 93.3%±6.5 | 93.4%±2.7 | NS (P |
| Walking test | 390.1m±95.1 | 380.3m±111 | NS (P |
FEV1%: forced expiratory volume in one second, percentage of predicted value; BMI: body mass index; PYI: pack-year index; NS: not significant; pb: post-bronchodilator; PBD(+): positive bronchodilator test; SatO2: oxygen saturation.
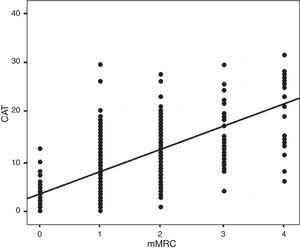
Distribution of mMRC vs CAT. Spearman correlation index: ρ=0.613; P
When the CAT questionnaire was used for classifying patients according to the GOLD 2011 criteria, the percentage distribution of patients to the groups was the following: category A, 34.3%; category B, 19.4%; category C, 19.8%, and category D, 26.5%. When the mMRC was applied, the result was: category A, 36.4%; category B, 17.3%; category C, 18.0%, and category D, 28.3% (Table 3 and Fig. 3).
Cohort GOLD 2011 Classification With CAT and mMRC (Fig. 3).
| GOLD CAT | GOLD mMRC | ||||
| A | B | C | D | Total | |
| A | 81 | 16 | 0 | 0 | 97 (35%) |
| B | 22 | 33 | 0 | 0 | 55 (19%) |
| C | 0 | 0 | 34 | 22 | 56 (20%) |
| D | 0 | 0 | 17 | 58 | 75 (26%) |
| Total | 103 (36%) | 49 (17%) | 51 (18%) | 80 (29%) | 283 (100%) |
Explanatory note: Quando è stata applicata la scala mMRC, 103 pazienti sono stati classificati come A; di questi, 22 sono stati classificati come B quando è stato applicato il questionario CAT. Allo stesso modo, quando è stata applicata la CAT, 97 pazienti sono stati classificati come A, ma 16 di questi sono stati poi classificati come B usando la mMRC. Con il mMRC, 49 pazienti erano classificati come B, ma 16 di questi erano stati classificati come A usando il CAT; con il CAT, 55 pazienti erano classificati come B, ma 22 di questi erano stati classificati come A con il mMRC. La stessa situazione si presentava per le categorie C e D, a seconda che si applicasse un questionario o l’altro. Non c’era migrazione tra AB e CD, poiché questa dipende dai criteri di rischio (AB: basso rischio; CD: alto rischio), come si può vedere nella Fig. 1.
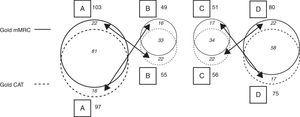
Schematic of migration between GOLD categories depending on results of the application of CAT or mMRC (see distribution of data and explanatory note in Table 3).
When the results from the application of both evaluation methods were examined, it was found that in category A, the classification of 81 patients coincided (83.5% of those classified using CAT and 78.6% of those classified with mMRC). In category B, the classification of 33 patients coincided (60% of those classified with CAT and 67.34% of those classified with mMRC). Nella categoria C, la classificazione di 34 pazienti coincideva (60,7% di quelli classificati con CAT e 66,7% di quelli classificati con mMRC). Nella categoria D, la classificazione di 58 pazienti coincideva (77,3% di quelli classificati con CAT e 72,5% di quelli classificati con mMRC) (Tabella 3 e Fig. 3).
Il coefficiente κ per la classificazione dei pazienti utilizzando i 2 metodi era 0,63, indicando un moderato grado di concordanza. L’indice κ calcolato era 0,44 per i 152 pazienti assegnati alle categorie A e B (grado di concordanza moderato-debole). L’indice per i 131 pazienti classificati nelle categorie C e D era 0,38, indicando un grado di concordanza ancora più scarso (debole). Ciò implica che per le categorie a basso rischio (A e B), la concordanza ottenuta era del 75%, mentre per le categorie ad alto rischio (C e D), la concordanza era del 70%.
The clinical and functional characteristics of the patients in each of the GOLD 2011 categories, depending on the method applied (CAT or mMRC), are shown in Table 4. There were no differences in the categories for age and body mass index (BMI) between patients classified by mMRC or CTA. Only the pack-year index (PYI) was significantly different between category D and the other categories, regardless of whether the classification was made by mMRC or CAT (PP
PP=.003).
Main Clinical and Functional Characteristics of Patients Assigned to GOLD 2011 Categories, as Classified Using mMRC or CAT.
| mMRC | A | B | C | D | CAT | A | B | C | D |
| Age | 70.3 | 70.5 | 69.1 | 72.3 | Age | 71.3 | 68.8 | 70.1 | 71.8 |
| BMI | 28.6 | 29.1 | 28.1 | 28.2 | BMI | 28.5 | 29.3 | 28.1 | 28.2 |
| PYI | 58.4 | 62.3 | 55.7 | 69.7a | PYI | 58.35 | 61.96 | 55.40 | 70.86a |
| pb FEV1% | 75.3 | 69.1 | 56.3 | 44.5 | pb FEV1% | 73.4 | 73.1 | 54.6 | 45.2 |
| Walking test | 414 | 364b | 417 | 344c | Walking test | 400 | 396 | 400 | 354d |
Values expressed as means for each category.
P
P
P
P=.003 vs category C.
Discussion
The recent revision of the GOLD 2011 guidelines proposes that when classifying COPD patients, the medical community should take into consideration not only functional deterioration, but also symptoms and risk of exacerbations.8 Per stabilire il grado di deterioramento funzionale, è stato proposto di mantenere gli stessi gradi di gravità di quelli attualmente utilizzati, cioè lieve (pbFEV1%>80%), moderato (pbFEV1%≥80% e 1
%≥30% e 1% 30%). Il rischio di esacerbazione è determinato dalla storia di esacerbazioni nell’anno precedente la valutazione (10 e alto impatto per CAT≥10). I nostri risultati suggeriscono che l’uso dell’uno o dell’altro metodo di valutazione cambia l’assegnazione di un numero significativo di pazienti a una o un’altra categoria di gravità della BPCO secondo le nuove linee guida GOLD. Pertanto, questi metodi di valutazione non possono essere presi come equivalenti, in quanto vengono raccomandate diverse strategie di trattamento per un singolo paziente, a seconda dell’uso dell’uno o dell’altro metodo.
Il questionario CAT riflette gli effetti della malattia sulla salute del paziente. Si tratta di un questionario sulla qualità della vita specifico per la BPCO5,9,12,13 che valuta non solo la dispnea ma anche altri sintomi respiratori, come la presenza e l’intensità della tosse o dell’espettorato; ha inoltre un totale di 8 item, tra cui la capacità di esercizio, il sonno e le attività della vita quotidiana, producendo un punteggio compreso tra 0 e 40. Il CAT è un questionario semplice e può essere utile nella pratica clinica standard. Ha dimostrato di essere valido per discriminare la gravità del paziente.9,12,14,15 Tuttavia, non è uno strumento diagnostico; il suo scopo è quello di integrare le informazioni ottenute dalle misurazioni della funzione polmonare e si sa molto poco sul suo potenziale ruolo prognostico.14 Questo questionario è particolarmente sensibile all’effetto dei cambiamenti dello stato di salute dopo le esacerbazioni16 e all’effetto della riabilitazione respiratoria.17 Una recente revisione ha confermato la validità del CAT (tra altri questionari specifici) come strumento per misurare la qualità della vita nella BPCO, quando particolarmente confrontato con altri strumenti generici. Sfortunatamente, questa revisione non ha analizzato la validità del ruolo della mMRC.5 La mMRC è una scala di dispnea più facile da usare, in particolare nelle cure primarie,18 e può essere incorporata in strumenti multidimensionali per la valutazione della BPCO, come il BODE6 e l’ADO (età, dispnea, ostruzione).19 Inoltre, la dispnea si correla meglio con la qualità della vita dei pazienti con BPCO rispetto ai parametri funzionali oggettivi.10,15 La determinazione clinica della dispnea rivela la capacità funzionale del paziente e fornisce una misura dell’efficacia del trattamento,20 mentre si correla strettamente con la sopravvivenza a 5 anni nei pazienti con BPCO.21 Ha anche mostrato una maggiore capacità predittiva riguardo all’esito della riabilitazione respiratoria, indipendentemente dal grado di ostruzione.6,18,21
Non ci sono state differenze significative in età, BMI e FEV1 tra i pazienti dei gruppi A e B e C e D, sia che fossero classificati con mMRC o CAT. Tuttavia, la capacità di esercizio dei pazienti nei gruppi B vs A e D vs C è più bassa quando sono stati classificati usando mMRC piuttosto che CAT. Questo suggerisce che la dispnea è molto più importante della qualità della vita come variabile che influenza la vita quotidiana dei pazienti con BPCO.
I pazienti con BPCO inclusi nella nostra coorte hanno caratteristiche demografiche, cliniche e funzionali simili a quelle di altri studi pubblicati in letteratura, e anche la distribuzione dei pazienti nelle diverse categorie è simile.22 Nella nostra serie, la correlazione ottenuta tra l’uso del CAT o del mMRC era moderata (ρ=0,613) e simile a quella di un altro studio di coorte trasversale.13 Secondo i nostri risultati, l’applicazione del CAT o del mMRC per classificare i pazienti nelle nuove categorie GOLD 2011 comporterebbe una riclassificazione dei pazienti nelle categorie a basso (A e B) e ad alto rischio (C e D). Il calcolo dell’indice di concordanza a seconda che venga applicata la CAT o la mMRC è moderatamente debole per le categorie A-B (κ=0,44), e ancora più debole per le categorie C-D (κ=0,38). In termini relativi, questo si traduce in una concordanza del 75% nelle categorie A e B e del 70% nelle categorie C e D. Quindi, l’uso di questi due metodi di valutazione non è equivalente, e più del 25% dei pazienti viene riclassificato dopo l’uso dell’uno o dell’altro metodo. Questo risultato ha un impatto considerevole sulle strategie di trattamento per i pazienti riclassificati. Le maggiori differenze di trattamento si trovano tra le categorie A (il trattamento farmacologico di prima linea raccomandato è basato su broncodilatatori a breve durata d’azione) e B (il trattamento farmacologico di prima linea raccomandato è basato su broncodilatatori a lunga durata d’azione e riabilitazione polmonare). Ci sono state piccole differenze tra le categorie C e D, che riguardano solo le opzioni di trattamento farmacologico alternativo, mentre le raccomandazioni per il trattamento non farmacologico sono le stesse.8
Un recente studio che ha anche confrontato il risultato dell’applicazione di entrambi i metodi di valutazione ha concluso in modo simile che la nuova classificazione GOLD 2011 potrebbe aver bisogno di alcuni aggiustamenti. Questi autori propongono un nuovo cut-off point per l’applicazione della scala mMRC (pochi sintomi=0; più sintomi≥1).23 Altri due studi, anch’essi recenti, condotti in Corea del Sud e negli Stati Uniti, in ambienti geografici e socioculturali molto diversi dalla Spagna, hanno ottenuto risultati identici ai nostri e tratto conclusioni simili. Uno di questi studi ha analizzato 257 pazienti sudcoreani in un unico centro e ha ottenuto risultati equivalenti ai nostri.24 L’altro studio era uno studio multicentrico che includeva 4484 soggetti nordamericani con BPCO, come parte dello studio COPDGene. Hanno analizzato i risultati dell’applicazione del mMRC o del questionario SGRQ (come surrogato del CAT) e hanno concluso in modo simile che la scelta dell’uno o dell’altro strumento per misurare i sintomi influenza l’assegnazione delle categorie.25
Nell’ultima revisione GOLD 2013, la valutazione dei pazienti con BPCO è stata aumentata con l’inclusione del Clinical COPD Questionnaire (CCQ).26 Nella sezione iniziale della revisione, Methodology and Summary of New Recommendations, e più avanti nella sezione Symptom Evaluation, viene chiarito che si tratta di un questionario autosomministrato appositamente progettato per misurare il monitoraggio clinico dei pazienti con BPCO. La revisione sottolinea che i dati supportano la validità, l’affidabilità e la sensibilità di questo questionario breve e facilmente somministrabile. Precisa che sulla base delle conoscenze attuali, il cut-off di CCQ=0-1 può essere considerato per classificare i pazienti nei gruppi A e C, e un risultato di CCQ>1 può essere utilizzato per classificare i pazienti nei gruppi B o D. Tuttavia, gli autori dichiarano che sono necessari più studi per convalidare la capacità discriminativa e le implicazioni pratiche del CCQ nel rilevamento delle esacerbazioni nella cura quotidiana. E poi, successivamente, nella sezione sulla valutazione combinata della BPCO, viene mantenuta la stessa proposta di valutazione combinata avanzata nelle linee guida GOLD 2011, basata solo su CAT o mMRC per la valutazione sintomatica del grado di coinvolgimento della BPCO, senza alcuna menzione esplicita del CCQ26
Lo studio qui presentato ha alcuni limiti: la dimensione del campione è relativamente piccola, anche se la maggior parte degli studi sugli strumenti di misurazione della BPCO hanno un numero simile o inferiore di pazienti.5,24 Inoltre, non essendo questo uno studio trasversale, il valore prognostico dei risultati non è stato registrato. Né è stata stabilita alcuna correlazione con le comorbidità tra le diverse categorie. Le comorbilità presentate dai pazienti possono avere un effetto significativo sulla prognosi della malattia e dovrebbero essere prese in considerazione anche per la valutazione combinata della BPCO in qualsiasi futura revisione delle linee guida GOLD.27
Conclusioni
La classificazione dei pazienti con BPCO in categorie secondo la valutazione combinata proposta dalla revisione GOLD 2011 varia a seconda del metodo di valutazione utilizzato nella valutazione sintomatica dei pazienti (CAT o mMRC). Più del 25% dei pazienti nelle diverse categorie sono riclassificati se si usa l’uno o l’altro metodo, il che implica differenze nella strategia di trattamento raccomandata. Sono necessari studi longitudinali per valutare quale metodo di valutazione classifichi meglio il paziente, con attenzione alla capacità prognostica di tali strumenti.
Conflitto di interessi
Gli autori dichiarano di non avere conflitti di interesse nella preparazione di questo manoscritto.