Come funziona una batteria per auto e come è costruita?
La funzione tradizionale della batteria nel vano motore è ben nota: Senza la batteria il veicolo non può essere avviato. Oltre al motorino d’avviamento, le candele, le candelette, le luci e le applicazioni elettroniche richiedono tutte energia elettrica. Ma come è costruita una batteria e come funziona?
Batterie al piombo-acido: Componenti e struttura
Molti automobilisti si rendono conto del peso elevato delle batterie per auto quando ne comprano una nuova. Sono possibili pesi da circa 10,5 kg, fino a 30 kg. La ragione di ciò sono le piastre di piombo nelle celle della batteria.
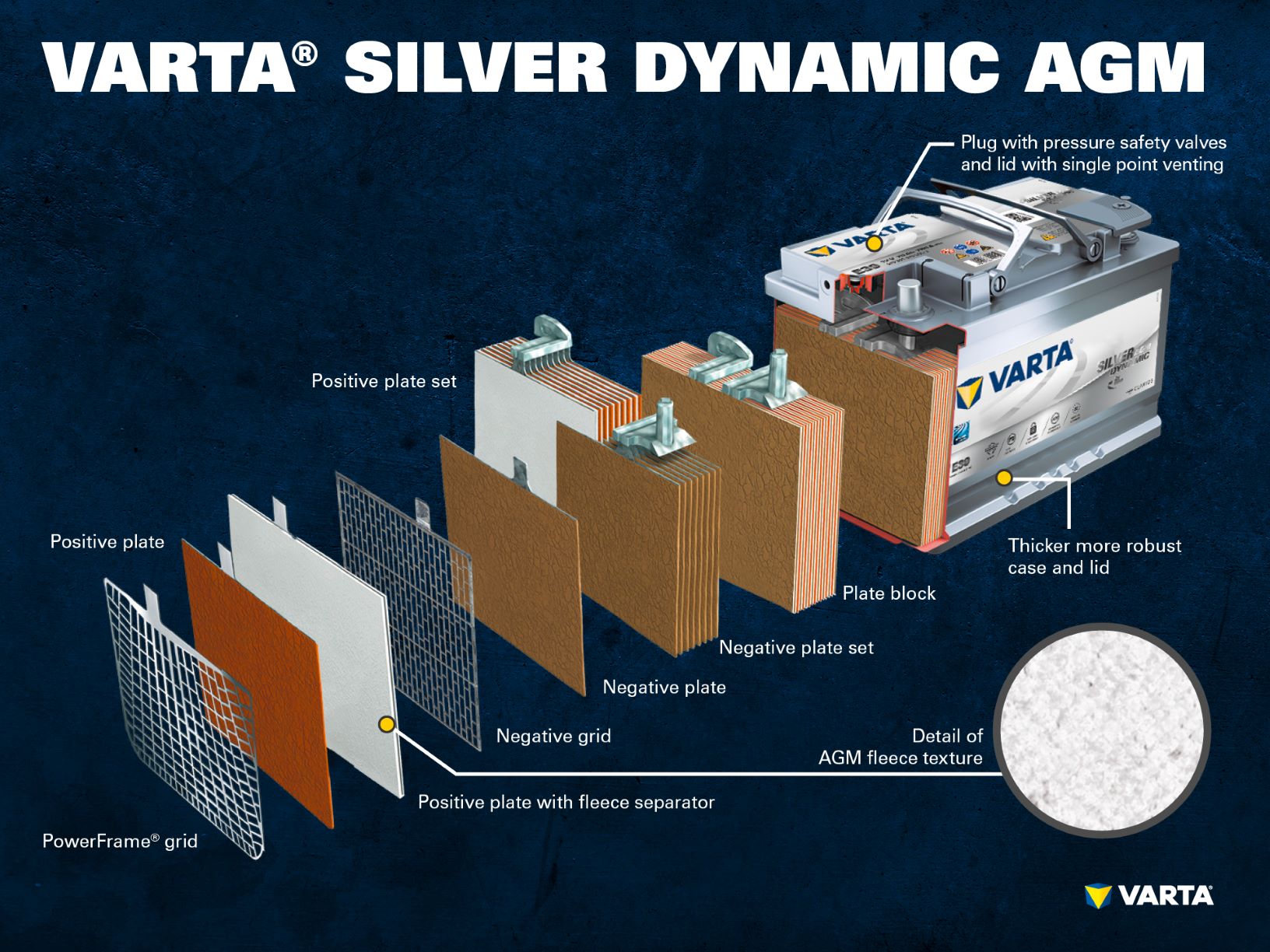
Componenti e struttura di una cella della batteria
Elettrodo positivo:
- Piastra positiva: In una batteria piombo-acido, la piastra positiva (materiale attivo) è costituita da ossido di piombo (PbO2) che è immerso in un elettrolita.
- Griglia positiva: La griglia positiva consiste in una lega di piombo ed è usata per tenere il materiale attivo e come collettore di corrente.
Elettrodo negativo:
- Piastra negativa: La piastra con carica negativa (materiale attivo) è costituita da piombo puro (Pb), che è anche immerso in un elettrolita.
- Piastra negativa: Come la piastra positiva, anche questa è costituita da una lega di piombo e serve allo stesso scopo.
Gli elettrodi con cariche diverse sono separati da un sacchetto separatore.
L’elettrolita è una miscela di acido solforico (H2SO4) e acqua distillata. Questo elettrolita può essere in forma liquida (come nelle batterie a umido convenzionali o nella tecnologia EFB migliorata), in forma di gel, o legato in un tappetino di vetro (come nella tecnologia AGM per le più recenti applicazioni start-stop).
Diversi elettrodi positivi formano una piastra positiva e diversi elettrodi negativi formano una piastra negativa. Insieme, una piastra negativa e una positiva formano un blocco di piastre. Un blocco di piastre è una cella della batteria.
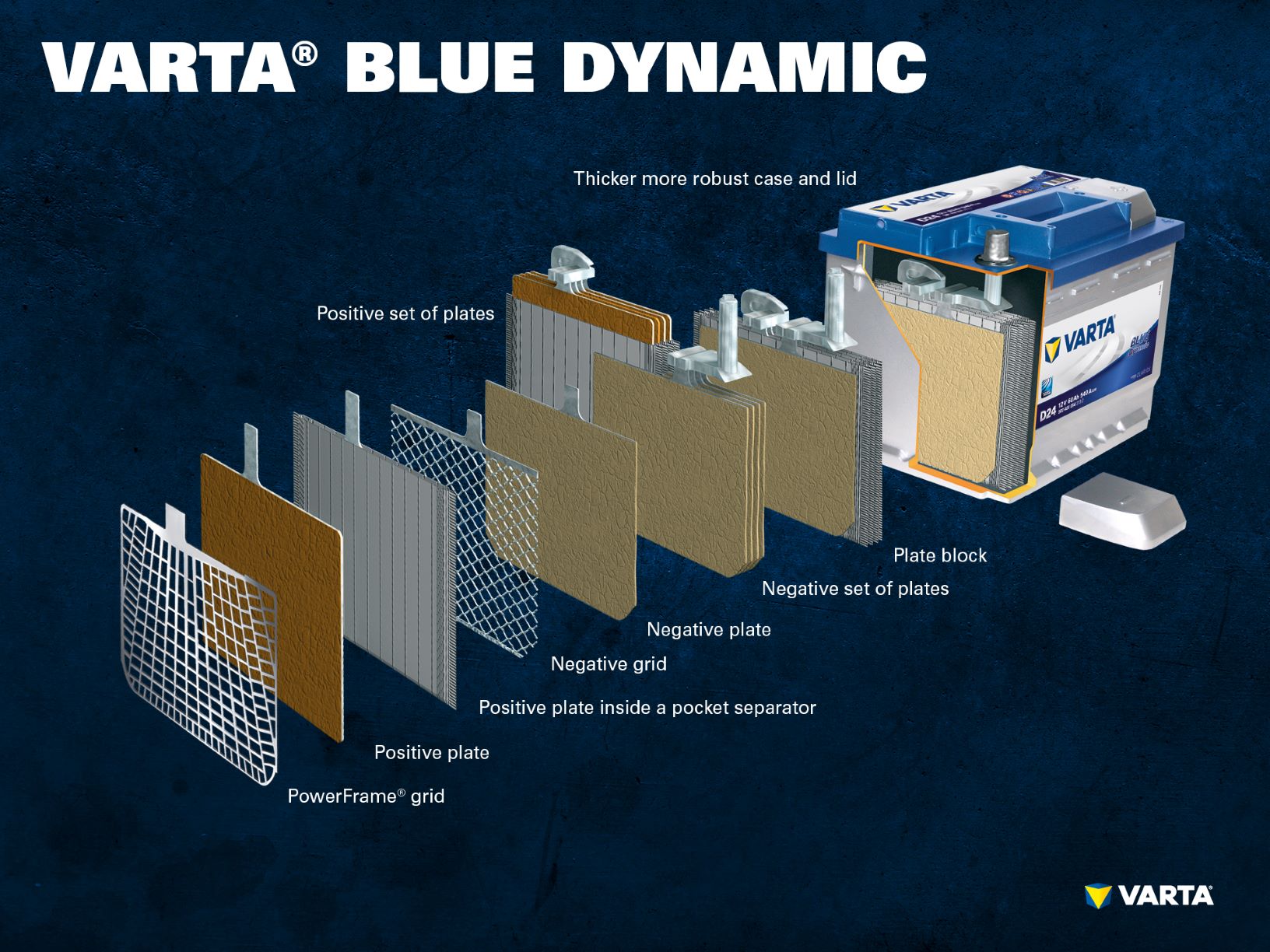
Una batteria di avviamento convenzionale consiste di 6 celle collegate in serie, ciascuna con una tensione nominale di 2 V, che risulta in una tensione di esattamente 12,72 V quando la batteria è completamente carica. La capacità e la capacità di partenza a freddo della batteria risultano dal numero di piastre per cella.
Regola empirica: Più piastre contiene una cella, e quindi formano una superficie più grande, più grande è la potenza di avviamento a freddo (CCA) che la batteria può fornire. Tuttavia, se lo spazio nella cella è utilizzato per meno piastre, ma più spesse, la stabilità del ciclo è aumentata. Questo significa che la batteria è progettata per una maggiore capacità di carica (processo continuo di carica e scarica).
Le celle sono contenute in un involucro fatto di plastica resistente agli acidi (polipropilene). In una batteria SLI convenzionale, questo è chiuso da un coperchio con un sistema a labirinto che impedisce la fuoriuscita del liquido della batteria e separa il liquido dal gas.
Le prime batterie avevano dei tappi a vite che permettevano il rabbocco con acqua distillata. Le batterie moderne sono completamente prive di manutenzione. L’acqua non ha bisogno e non deve essere rabboccata. Anche se le batterie AGM hanno ancora i “tappi a vite”, questi non devono essere aperti in nessun caso.
Funzione della batteria dell’auto: L’energia chimica diventa energia elettrica
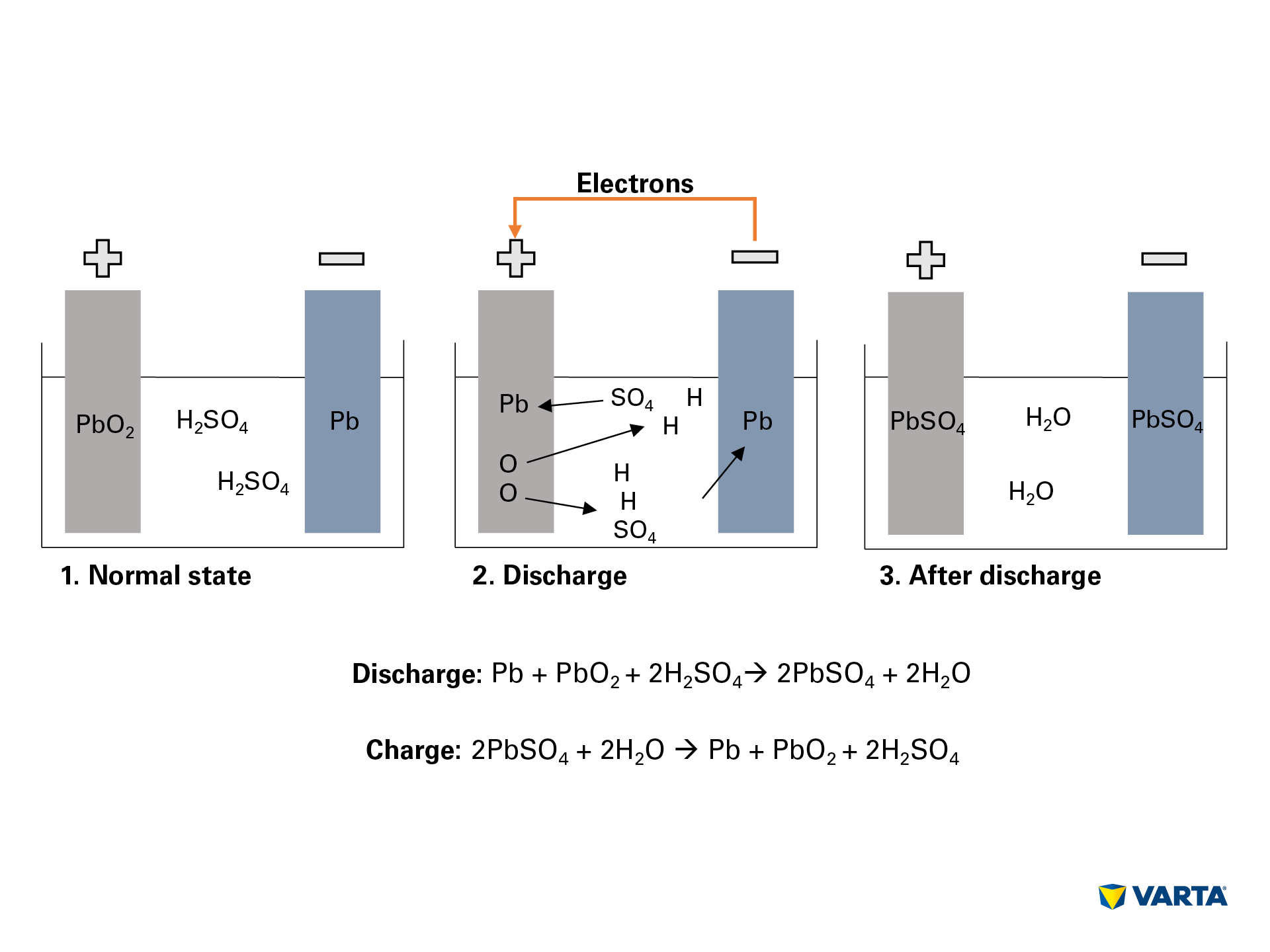
Una batteria per auto immagazzina energia in forma chimica e la converte in energia elettrica. In questo processo elettrochimico, quattro materiali reagiscono tra loro:
- Idrogeno (H)
- Ossigeno (O2)
- Piombo (Pb)
- Zolfo (S)
La connessione di un consumatore esterno avvia la reazione chimica nella batteria:
- L’elettrolita, una miscela di acido solforico (H2SO4) e acqua distillata, si decompone in ioni idrogeno (H+) e ioni solfato (SO42-) con carica positiva.
- Al tempo stesso, gli elettroni (2e-) viaggiano dal negativo all’elettrodo positivo attraverso il consumatore esterno.
- Per compensare questo flusso di elettroni, gli ioni solfato viaggiano dall’elettrolita nell’elettrodo negativo, dove reagiscono con il piombo (Pb) per produrre solfato di piombo (PbSO4).
- Il solfato di piombo è prodotto anche nell’elettrodo positivo: Il legame dell’ossigeno (O2) nell’ossido di piombo (PbO2) è rotto dal trasferimento di elettroni e l’ossigeno passa nell’elettrolita. Il piombo rimanente (Pb) si lega con il solfato (SO4) dell’elettrolita.
- Lì, l’ossigeno si lega con l’idrogeno per formare acqua (H2O). Man mano che l’acido solforico viene consumato dalla formazione di solfato di piombo, la concentrazione della soluzione elettrolitica si riduce. Quando la concentrazione dell’acido solforico scende sotto un certo livello, la batteria deve essere ricaricata.
- Durante la carica, i processi chimici avvengono in sequenza inversa. Alla fine, gli elementi originali possono essere ritrovati: L’elettrodo positivo consiste in solfato di piombo (PbSO4), l’elettrodo negativo consiste in piombo puro (Pb) e l’elettrolita consiste in acido solforico diluito (H2SO4). Poiché questo processo di conversione è associato a perdite, una batteria può sopportare solo un numero limitato di cicli di carica. La sua vita utile è quindi limitata.
Problemi con le batterie piombo-acido: Solfatazione e stratificazione dell’acido
Se una batteria viene caricata con una tensione troppo bassa, o se funziona sempre con una tensione troppo bassa (sotto l’80%) si verifica la stratificazione dell’acido, detta anche stratificazione. L’acido nell’elettrolita si stratifica a causa di una cattiva miscelazione. Diverse densità causano la stratificazione dell’acido solforico sul fondo e dell’acqua nella zona superiore della batteria. A causa di ciò, solo la parte centrale dell’elettrolito, cioè solo un terzo, può essere usata per il processo di scaricamento e di carica.
Una possibile causa di stratificazione dell’acido è soprattutto i viaggi brevi con l’uso simultaneo di un gran numero di utenze elettriche. In questo caso, l’alternatore non ha abbastanza tempo per ricaricare la batteria. 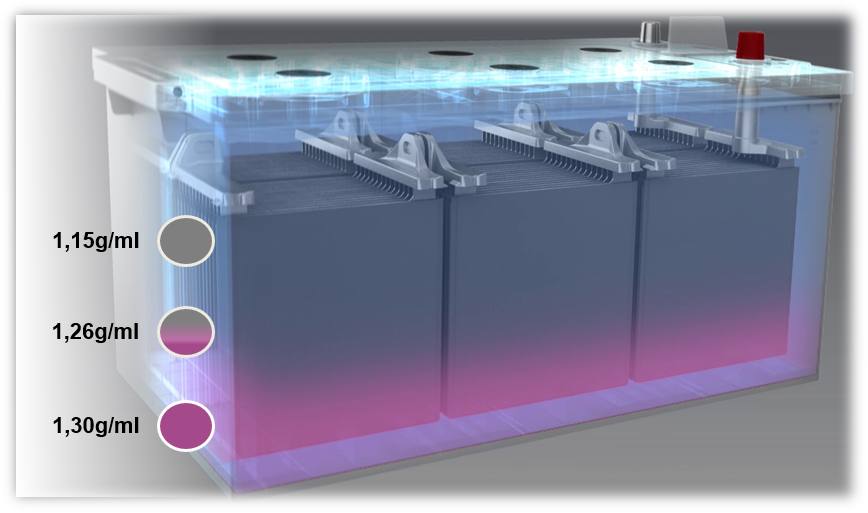
Un risultato della stratificazione dell’acido è la solfatazione. Se questo avviene nella batteria, o se non è costantemente caricata ad un livello adeguato, il solfato di piombo (PbSO4) cristallizza sugli elettrodi, per formare strutture cristalline più grandi nel corso del tempo. Questo processo è noto come “solfatazione”. La cristallizzazione impedisce la riconversione del solfato di piombo nei componenti originali piombo o ossido di piombo, il che impedisce l’accettazione della carica e riduce la potenza di avviamento a freddo.
I cristalli appuntiti possono anche danneggiare i separatori o causare cortocircuiti nelle celle.
Per contrastare questo effetto e prevenire la rottura prematura della batteria, una batteria non dovrebbe mai essere sottoposta a un basso livello di carica per un lungo periodo. Per questo, si consiglia di testare la batteria regolarmente e di caricarla completamente se necessario.
Vuoi saperne di più su questo argomento? Come caricare correttamente una batteria.
Nuove tecnologie per le batterie: AGM e ioni di litio
Fino ad ora, le batterie al piombo convenzionali hanno avuto un’alta quota di mercato. Tuttavia, il mercato sta cambiando rapidamente: Le tecnologie innovative delle batterie per veicoli start-stop come AGM utilizzano acido legato in una stuoia per fornire una maggiore stabilità del ciclo e garantire prestazioni affidabili nei veicoli con un maggiore fabbisogno energetico. Un ulteriore vantaggio di AGM: la stratificazione dell’acido non è più possibile a causa dell’acido legato.
Una nuova generazione di batterie per auto per veicoli micro-ibridi funziona a 48V e utilizza celle con tecnologia agli ioni di litio.