H2S Lewis Structure, Molecular Geometry, Hybridization and Polarity
Hydrogen Sulfide is a common chemical compound that is useful for analyzing inorganic compounds of metal ions. It has the chemical formula of H2S. The molecule has two Hydrogen atoms and a single Sulfur atom. H2S is also a precursor for elemental Sulfur. It also plays a vital role in signaling pathways in the human body. So to understand the hybridization, polarity, and molecular geometry of this compound, it is essential to know its Lewis structure.
| Name of molecule | Hydrogen Disulfide ( H2S) |
| No of Valence Electrons in the molecule | 8 |
| Hybridization of CO2 | sp3 hybridization |
| Bond Angles | 104.5 degrees |
| Molecular Geometry of CO2 | Bent |
Before knowing its Lewis structure, let us calculate the total number of valence electrons in Hydrogen Sulfide as these electrons participate in bond formation and help us study Lewis structure with ease.
Contents
Valence electrons of H2S
To know the total number of valence electrons in Hydrogen Sulfide we need to add the valence electrons of both Hydrogen and Sulfur atoms. There are two atoms of Hydrogen and a single atom of Sulfur in the compound.
Each Hydrogen atom has only one electron which is also its valence electron
Hence there are two valence electrons for Hydrogen atom ( as there are two Hydrogen atoms)
Sulfur has six valence electrons.
Total number of valence electrons in H2S
= 2(1) + 6
= 8
Thus, there are a total of eight valence electrons in H2S.
Struttura di Lewis dell’H2S
La struttura di Lewis di qualsiasi composto è una rappresentazione strutturale degli elettroni di valenza che partecipano alla formazione del legame insieme alle coppie di elettroni non leganti. Conoscere la struttura di Lewis di un dato composto chimico è essenziale perché fornisce le informazioni necessarie su tutte le altre proprietà chimiche del composto.
La rappresentazione viene visualizzata usando punti e linee che rappresentano gli elettroni. I punti rappresentano gli elettroni che non partecipano alla formazione del legame. Mentre le linee rappresentano i legami nel composto. La struttura è fatta in base alla regola dell’ottetto. La regola dell’ottetto della chimica afferma che ci dovrebbero essere otto elettroni nel guscio esterno di un elemento perché sia stabile.
La struttura di Lewis del solfuro di idrogeno è facile da disegnare e capire. In questo composto, entrambi gli atomi di idrogeno richiedono un elettrone per fare il legame covalente con lo zolfo. La struttura di Lewis dell’H2S è simile all’H2S. Lo zolfo ha bisogno di otto elettroni per soddisfare i requisiti della regola dell’ottetto. Ma l’idrogeno richiede solo un singolo elettrone per diventare stabile in quanto appartiene al gruppo 1 degli elementi.
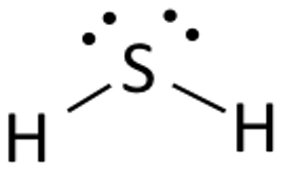
Posiziona l’atomo di zolfo al centro e disponi i suoi elettroni di valenza intorno ad esso.
Posiziona ora due atomi di idrogeno su entrambi i lati dell’atomo centrale.
Qui gli elettroni di valenza dello zolfo sono usati per rendere stabile l’idrogeno donando un elettrone ad entrambi gli atomi di idrogeno. Due dei sei elettroni di valenza partecipano alla formazione del legame.
Disegna delle linee (per mostrare i legami) tra gli atomi di idrogeno e di zolfo.
I rimanenti quattro elettroni sono elettroni non leganti e sono quindi visualizzati come punti vicino all’atomo di zolfo. In totale ci sono due coppie di elettroni non leganti in questo composto e gli atomi di idrogeno hanno un guscio di valenza completo.
Ibridazione dell’H2S
Per capire l’ibridazione dell’H2S, è vitale sapere prima due cose:
- Il numero di legami nel composto e il suo tipo
È essenziale conoscere il tipo di legame nel composto per conoscere la sua ibridazione. Nella molecola H2S, due atomi di idrogeno formano un legame con l’atomo di zolfo centrale. Nella molecola si formano due legami singoli. Questi legami occupano quattro elettroni di valenza, e quindi rimangono altri quattro elettroni di valenza. Mentre si forma un legame, l’orbitale s dell’atomo di idrogeno si sovrappone all’orbitale p dell’atomo di zolfo. La coppia solitaria di elettroni occupa due degli orbitali sp3. Gli altri due orbitali di sp3 si sovrappongono all’orbitale 1s dell’atomo di idrogeno.
Questa disposizione porta all’ibridazione sp3 della molecola H2S. La sovrapposizione dei due orbitali ibridi forma due legami sigma tra l’idrogeno e l’atomo di zolfo.
- Il numero sterico del composto dato
Il numero sterico è definito come la regione di densità elettronica vista intorno all’atomo centrale. In questo caso, poiché lo zolfo è l’atomo centrale, il numero sterico del composto sarà il totale cumulativo degli atomi legati all’atomo centrale e il numero di coppie solitarie di elettroni intorno all’atomo centrale.
La formula per trovare questo numero è:
Numero sterico (SN)
= No di legami sigma sull’atomo centrale +No di coppie solitarie pi sull’atomo centrale
In questo caso di molecole H2S, ci sono due legami sigma, e ci sono due coppie solitarie di elettroni sull’atomo centrale.

Quindi SN della molecola H2S = 2+2
=4
Come il numero sterico di H2S è quattro, ha due
orbitali ibridi e due coppie solitarie di elettroni che la rendono una ibridazione sp3.
Ora che conosciamo la struttura di Lewis e l’ibridazione della molecola, è facile determinare la sua geometria molecolare.
Geometria molecolare di H2S
L’ibridazione della molecola H2S è sp3; l’atomo di zolfo è in legame centrale con due atomi di idrogeno formando un angolo di legame inferiore a 180 gradi. Secondo la teoria VSEPR, le coppie solitarie di elettroni si respingono a vicenda, ma poiché l’atomo di zolfo è meno elettronegativo, l’angolo di legame diminuisce a 104,5 gradi.
Questa diminuzione dell’angolo porta ad una struttura piegata.
Un altro modo per conoscere la geometria molecolare è il metodo AXN. Dove A denota l’atomo centrale, X è per il numero di coppie di elettroni legati e N è per la coppia solitaria di elettroni. Qui la formula generale sarà AX2N2 a causa di due coppie di legame e due coppie solitarie di elettroni. Così questa molecola mostra una geometria piegata.
Polarità dell’H2S
Ora che abbiamo le informazioni richieste sulla molecola, è facile determinare la sua polarità. La polarità di qualsiasi molecola dipende dalla sua geometria molecolare e dall’elettronegatività generale. Poiché l’atomo di zolfo è meno elettronegativo, l’elettronegatività complessiva del composto è inferiore a 0,4, il che lo rende non polare.
Quindi si può dire che la molecola H2S è nonpolare.
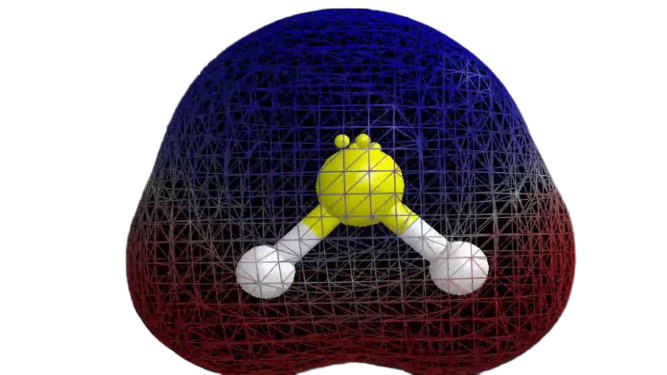
Riservazioni conclusive
Dalle informazioni precedenti, si può concludere che la molecola H2S ha otto elettroni di valenza, ibridazione sp3, geometria molecolare piegata, ed è nonpolare.