Le prime idee sulla materia: Da Democrito a Dalton
Teoria atomica moderna

Priestley, Lavoisier e altri avevano gettato le basi del campo della chimica. I loro esperimenti dimostrarono che alcune sostanze potevano combinarsi con altre per formare nuovi materiali, altre sostanze potevano essere scomposte per formarne altre più semplici, e alcuni “elementi” chiave non potevano essere ulteriormente scomposti. Ma cosa poteva spiegare questa complessa serie di osservazioni? John Dalton, un eccezionale insegnante e scienziato britannico, mise insieme i pezzi e sviluppò la prima teoria atomica moderna nel 1803. Per saperne di più sugli esperimenti di Priestley e Lavoisier e su come hanno formato la base delle teorie di Dalton, prova l’esperimento interattivo Dalton’s Playhouse, collegato qui sotto.
Dalton aveva l’abitudine di seguire e registrare il tempo nella sua città natale, Manchester, Inghilterra. Attraverso le sue osservazioni della nebbia mattutina e di altri modelli meteorologici, Dalton si rese conto che l’acqua poteva esistere come un gas che si mescolava con l’aria e occupava lo stesso spazio dell’aria. I solidi non potevano occupare lo stesso spazio degli altri; per esempio, il ghiaccio non poteva mescolarsi con l’aria. Quindi cosa potrebbe permettere all’acqua di comportarsi a volte come un solido e a volte come un gas? Dalton si rese conto che tutta la materia deve essere composta da minuscole particelle. Nello stato di gas, queste particelle galleggiavano liberamente e potevano mescolarsi con altri gas, come aveva proposto Bernoulli. Ma Dalton estese questa idea per applicarla a tutta la materia – gas, solidi e liquidi. Dalton propose per la prima volta parte della sua teoria atomica nel 1803 e in seguito perfezionò questi concetti nel suo classico documento del 1808 A New System of Chemical Philosophy (a cui si può accedere tramite un link nella scheda Risorse).
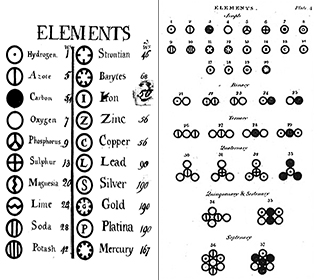
La teoria di Dalton aveva quattro concetti principali:
-
Tutta la materia è composta da particelle indivisibili chiamate atomi. Bernoulli, Dalton e altri immaginarono gli atomi come minuscole particelle simili a palle da biliardo in vari stati di moto. Sebbene questo concetto sia utile per aiutarci a capire gli atomi, non è corretto, come vedremo nei moduli successivi sulla teoria atomica, collegati in fondo a questo modulo.
-
Tutti gli atomi di un dato elemento sono identici; gli atomi di elementi diversi hanno proprietà diverse. La teoria di Dalton suggeriva che ogni singolo atomo di un elemento come l’ossigeno è identico ad ogni altro atomo di ossigeno; inoltre, gli atomi di elementi diversi, come l’ossigeno e il mercurio, sono diversi tra loro. Dalton caratterizzava gli elementi in base al loro peso atomico; tuttavia, quando gli isotopi degli elementi furono scoperti alla fine del 1800, questo concetto cambiò.
-
Le reazioni chimiche coinvolgono la combinazione di atomi, non la distruzione di atomi. Gli atomi sono indistruttibili e immutabili, quindi i composti, come l’acqua e il calx di mercurio, si formano quando un atomo si combina chimicamente con altri atomi. Questo era un concetto estremamente avanzato per il suo tempo; mentre la teoria di Dalton implicava che gli atomi si legassero tra loro, ci sarebbero voluti più di 100 anni prima che gli scienziati iniziassero a spiegare il concetto di legame chimico.
-
Quando gli elementi reagiscono per formare composti, reagiscono in rapporti definiti e interi. Gli esperimenti che Dalton e altri eseguirono dimostrarono che le reazioni non sono eventi casuali; esse procedono secondo formule precise e ben definite. Questo importante concetto in chimica è discusso più in dettaglio qui di seguito.
Comprensione Checkpoint
Un elemento è composto da
Alcuni dettagli della teoria atomica di Dalton richiedono maggiori spiegazioni.
Elementi: Già nel 1660, Robert Boyle riconobbe che la definizione greca di elemento (terra, fuoco, aria e acqua) non era corretta. Boyle propose una nuova definizione di elemento come sostanza fondamentale, e noi ora definiamo gli elementi come sostanze fondamentali che non possono essere scomposte ulteriormente con mezzi chimici. Gli elementi sono i mattoni dell’universo. Sono sostanze pure che costituiscono la base di tutti i materiali che ci circondano. Alcuni elementi possono essere visti in forma pura, come il mercurio in un termometro; altri li vediamo principalmente in combinazione chimica con altri, come l’ossigeno e l’idrogeno nell’acqua. Ora conosciamo circa 116 elementi diversi. A ciascuno degli elementi viene dato un nome e un’abbreviazione di una o due lettere. Spesso questa abbreviazione è semplicemente la prima lettera dell’elemento; per esempio, l’idrogeno è abbreviato come H, e l’ossigeno come O. A volte ad un elemento viene data un’abbreviazione di due lettere; per esempio, l’elio è He. Quando si scrive l’abbreviazione di un elemento, la prima lettera è sempre maiuscola e la seconda lettera (se c’è) è sempre minuscola.
Atomi: Una singola unità di un elemento è chiamata atomo. L’atomo è l’unità più elementare della materia, che compone ogni cosa nel mondo che ci circonda. Ogni atomo conserva tutte le proprietà chimiche e fisiche del suo elemento madre. Alla fine del diciannovesimo secolo, gli scienziati dimostrarono che gli atomi erano in realtà costituiti da pezzi più piccoli, “subatomici”, il che distrusse il concetto di palla da biliardo dell’atomo (vedi il nostro modulo Teoria Atomica I: Gli inizi).
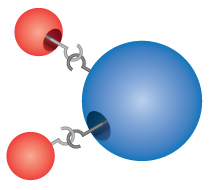
Composti: La maggior parte dei materiali con cui veniamo a contatto sono composti, sostanze formate dalla combinazione chimica di due o più atomi di elementi. Una singola “particella” di un composto è chiamata molecola. Dalton immaginava erroneamente che gli atomi si “agganciassero” insieme per formare le molecole. Tuttavia, Dalton ha capito correttamente che i composti hanno formule precise. L’acqua, per esempio, è sempre formata da due parti di idrogeno e una di ossigeno. La formula chimica di un composto si scrive elencando i simboli degli elementi insieme, senza spazi tra loro. Se una molecola contiene più di un atomo di un elemento, si mette un numero in pedice dopo il simbolo per mostrare il numero di atomi di quell’elemento nella molecola. Così la formula dell’acqua è H2O, mai HO o H2O2.
Comprehension Checkpoint
The formula for water can be written as either H2O or HO2.