Malattia di Lyme
Panoramica
Il primo caso di anaplasmosi umana è stato descritto nel 1990, quando un paziente del Wisconsin ha sviluppato una grave malattia febbrile dopo un morso di zecca ed è morto due settimane dopo. Gli strisci di sangue hanno rivelato grappoli di batteri all’interno dei neutrofili del paziente, simile alle morule visto in monociti con E. chaffeensis infezione. Tuttavia, le colture e le prove sierologiche per E. chaffeensis erano negative. Tuttavia, il corso clinico del paziente ha suggerito il ehrlichiosis di un certo genere e quando parecchi casi supplementari della malattia sono stati segnalati nel Midwest settentrionale negli anni successivi, è stato proposto che una nuova specie di Ehrlichia potrebbe emergere. Alla nuova malattia fu provvisoriamente dato il nome di “ehrlichiosi granulocitica umana” o HGE.
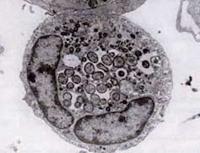
Nel 1994, gli studi di sequenziamento del DNA hanno rivelato che l’agente HGE era chiaramente distinto da E. chaffeensis ma essenzialmente identico a due patogeni veterinari ehrlichi precedentemente noti, E. equi ed E. (Cytoecetes) phagocytophila. Secondo un nuovo schema tassonomico da allora implementato, questi tre organismi sono stati uniti come una singola specie all’interno di un nuovo genere, Anaplasma. La nuova specie è denominata Anaplasma phagocytophilum, e la malattia che causa è ora conosciuta come anaplasmosi granulocitica umana, o HGA.
Come le specie Ehrlichia, gli organismi Anaplasma sono piccoli, gram-negativi e intracellulari. A. phagocytophilum prende di mira i neutrofili, altera la loro funzione nell’ospite e forma morule all’interno di vacuoli. La maggior parte dei danni che provoca sembra essere correlata ai processi infiammatori dell’ospite, dato che ci sono poche prove di una correlazione tra il numero di organismi e la gravità della malattia dell’ospite.
L’anaplasmosi è un’infezione globale, che si verifica in Nord America, nella maggior parte dell’Europa e in Asia orientale. Le zecche del complesso Ixodes persulcatus sono i vettori: I. scapularis nel nord-est e nelle regioni superiori del Midwest degli Stati Uniti; I. pacificus nel nord-ovest del Pacifico; I. ricinus in Europa; e I. persulcatus in Asia. A. phagocytophilum è mantenuto in natura dal ciclismo tra queste zecche e vari piccoli mammiferi, soprattutto topi e altri piccoli roditori. Poiché le zecche Ixodes sono anche i vettori della malattia di Lyme, babesiosi, ed encefalite da zecche, la coinfezione da Anaplasma con queste altre malattie può verificarsi e si verifica negli esseri umani.
Negli Stati Uniti, i casi di HGA hanno superato quelli di Ehrlichiosi Umana Monocitica (HME) Simile alla HME e all’ehrlichiosi umana, l’età media dei pazienti con HGA è di circa 50 anni.
Segni e Sintomi
Il decorso clinico della HGA va dall’infezione asintomatica alla malattia mortale. I sintomi iniziali, che si verificano circa cinque a dieci giorni dopo il morso della zecca, sono in gran parte non specifici: febbre, brividi, mal di testa grave, e mialgie; j nausea, tosse e artralgie possono anche verificarsi. Rash è raro ma è stato segnalato.
Rispetto a HME, HGA sembra meno probabile di coinvolgere il sistema nervoso centrale, ma neuropatie periferiche (ad esempio, intorpidimento e formicolio) sono più comuni e possono durare settimane a mesi. Tra i risultati neurologici riportati nella letteratura medica ci sono paralisi facciale, polineuropatia demielinizzante e plessopatia brachiale. La sindrome da distress respiratorio e una sindrome settica o da shock tossico sono state riportate, ma sembrano essere meno comuni che nella HME. Il tasso complessivo di mortalità da HGA è molto basso (meno dell’1%), con la maggior parte dei decessi derivanti da infezioni opportunistiche (per esempio, esofagite da herpes simplex, polmonite da Candida e aspergillosi polmonare) in pazienti immunocompromessi.
Diagnosi
Le analisi del sangue standard nella HGA rivelano di solito risultati simili a quelli visti nella HME: leucopenia, trombocitopenia e anomalie della funzione epatica (transaminasi elevate). Tuttavia, le anomalie ematologiche spesso si risolvono entro la seconda settimana di sintomi, quindi la loro assenza dovrebbe essere interpretata in quel contesto se i pazienti si presentano più tardi nel corso della loro malattia. In generale, il trattamento antibiotico empirico dovrebbe essere considerato per i pazienti in aree endemiche che si presentano con una malattia febbrile acuta suggestiva di HGA.
Per la diagnosi specifica, gli strisci di sangue colorati con Wright o Giemsa hanno una resa leggermente superiore rispetto all’HME, ma non sono ancora ottimali per l’utilità clinica generale, dato che sembra esserci un’ampia variazione (25-75%) nella sensibilità di questi test nella visualizzazione delle morule nei neutrofili dell’ospite. Più utili, ma non sempre disponibili, sono i test di reazione a catena della polimerasi (PCR), che si stima abbiano una sensibilità del 67-90%. Una precedente terapia antibiotica riduce drasticamente la sensibilità di entrambi questi metodi diagnostici.
I test sierologici sono utili per confermare la diagnosi di anaplasmosi. Il metodo più comunemente usato è l’immunofluorescenza indiretta (IFA) degli anticorpi IgM e IgG anti-A. phagocytophilum. La sieroconversione è forse la prova di laboratorio più sensibile dell’infezione da A. phagocytophilum, ma non è sempre ottenuta in modo sufficientemente tempestivo da fornire un utile contributo alle decisioni cliniche (cioè di trattamento).