Oxygen family
La famiglia dell’ossigeno consiste negli elementi che compongono il gruppo 16 della tavola periodica: ossigeno, zolfo, selenio, tellurio e polonio. Questi elementi hanno tutti sei elettroni nel loro livello energetico più esterno, il che spiega alcune proprietà chimiche comuni tra loro. Sotto un altro aspetto, gli elementi sono abbastanza diversi l’uno dall’altro. L’ossigeno è un non metallo gassoso; lo zolfo e il selenio sono non metalli solidi; il tellurio è un metalloide solido e il polonio è un metallo solido.
Parole da sapere
Acido: Sostanze che, quando dissolte in acqua, sono capaci di reagire con una base per formare sali e rilasciare ioni idrogeno.
Allotropo: Una delle due o più forme di un elemento.
Combustione: Una forma di ossidazione che avviene così rapidamente da produrre calore e luce notevoli.
Cracking: Il processo attraverso il quale le grandi molecole di idrocarburi vengono scomposte in componenti più piccoli.
Elettrolisi: Il processo attraverso il quale una corrente elettrica causa un cambiamento chimico, di solito la scomposizione di qualche sostanza.
Isotopi: Due o più forme dello stesso elemento con lo stesso numero di protoni ma un diverso numero di neutroni nel nucleo atomico.
Litosfera: La parte solida della Terra, specialmente la regione esterna della crosta.
LOX: abbreviazione di ossigeno liquido.
Metallurgia: La scienza e la tecnologia che si occupa di ricavare i metalli dai loro minerali e di convertirli in forme che abbiano un valore pratico.
Ossigeno nascente: Un allotropo dell’ossigeno le cui molecole contengono ciascuna un singolo atomo di ossigeno.
Ozono: Un allotropo dell’ossigeno che consiste di tre atomi per molecola.
Gas produttore: Un combustibile sintetico che consiste principalmente di monossido di carbonio e idrogeno.
Proteine: Grandi molecole essenziali per la struttura e il funzionamento di tutte le cellule viventi.
Decadimento radioattivo: Il modo prevedibile in cui una popolazione di atomi di un elemento radioattivo si disintegra spontaneamente nel tempo.
Ossigeno
L’ossigeno è un gas incolore, inodore e insapore con un punto di fusione di -218°C (-360°F) e un punto di ebollizione di -183°C (-297°F). È l’elemento più abbondante nella crosta terrestre, costituendo circa un quarto dell’atmosfera in peso, circa la metà della litosfera (la crosta terrestre), e circa l’85% dell’idrosfera (gli oceani, i laghi e altre forme di acqua). Si presenta sia come elemento libero che in una grande varietà di composti. Nell’atmosfera, esiste come ossigeno elementare, a volte conosciuto come diossigeno perché consiste di molecole biatomiche, O 2 . Nell’acqua si presenta come ossido di idrogeno, H 2 O, e nella litosfera si presenta in composti come ossidi, carbonati, solfati, silicati, fosfati e nitrati.
L’ossigeno esiste anche in due forme allotropiche (forme fisicamente o chimicamente diverse della stessa sostanza): un atomo per molecola (O) e tre atomi per molecola (O 3 ). Il primo allotropo è conosciuto come ossigeno monoatomico, o nascente, e il secondo come ossigeno triatomico, o ozono. Nella maggior parte delle circostanze in natura, la forma biatomica dell’ossigeno predomina. Nella parte superiore della stratosfera, tuttavia, l’energia solare causa la rottura della forma biatomica nella forma monoatomica, che può poi ricombinarsi con molecole biatomiche per formare ozono. La presenza dell’ozono nell’atmosfera terrestre è fondamentale per la sopravvivenza della vita sulla Terra, poiché questo allotropo ha la tendenza ad assorbire le radiazioni ultraviolette che altrimenti sarebbero dannose o addirittura mortali per la vita vegetale e animale sulla superficie del pianeta.
L’ossigeno fu scoperto indipendentemente dal chimico svedese Carl Scheele (1742-1786) e dal chimico inglese Joseph Priestley (1733-1804) nel periodo tra il 1773 e il 1774. Il nome dell’elemento fu dato alla fine degli anni 1770 dal chimico francese Antoine Laurent Lavoisier (1743-1794). Il suo nome deriva dalla parola francese per “formatore di acidi”, riflettendo l’errata convinzione di Lavoisier che tutti gli acidi contengono ossigeno.
Produzione. Il metodo di gran lunga più comune per produrre ossigeno commercialmente è la distillazione frazionata di aria liquida. Un campione di aria viene prima raffreddato ad una temperatura molto bassa, nell’ordine dei -200°C (-330°F). A questa temperatura, la maggior parte dei gas che compongono l’aria diventano liquidi. L’aria liquida viene poi lasciata evaporare. A una temperatura di circa -196°C (-320°F), l’azoto comincia a bollire. Quando la maggior parte dell’azoto non c’è più, anche l’argon e il neon bollono, lasciando una forma impura di ossigeno. L’ossigeno è impuro perché piccole quantità di krypton, xeno e altri gas possono rimanere nella forma liquida. Per purificare ulteriormente l’ossigeno, il processo di raffreddamento, liquefazione ed evaporazione può essere ripetuto.
L’ossigeno è comunemente immagazzinato e trasportato nella sua forma liquida, una forma conosciuta anche come LOX (per l iquid ox ygen). I contenitori LOX hanno l’aspetto di grandi bottiglie sottovuoto che consistono in un contenitore a doppia parete con un vuoto tra le pareti. L’elemento può anche essere immagazzinato e trasportato meno facilmente in forma gassosa in contenitori con pareti d’acciaio alti circa 1,2 metri (4 piedi) e con 23 centimetri (9 pollici) di diametro. In molti casi, l’ossigeno viene prodotto nel luogo in cui verrà utilizzato. Il processo di distillazione frazionata descritto in precedenza è sufficientemente semplice e poco costoso in modo che molte industrie possano fornire i propri impianti di produzione di ossigeno.
Usi. L’ossigeno ha così tanti usi commerciali, industriali e di altro tipo che si colloca costantemente tra i primi cinque prodotti chimici per volume di produzione negli Stati Uniti. Nel 1990, per esempio, circa 18 miliardi di chilogrammi (39 miliardi di libbre) dell’elemento sono stati prodotti negli Stati Uniti.
Gli usi a cui è destinato l’ossigeno possono essere classificati in quattro grandi categorie: metallurgia, missilistica, sintesi chimica e medicina. Nella lavorazione del minerale di ferro in un altoforno, per esempio, l’ossigeno è usato per convertire il coke (carbonio) in monossido di carbonio. Il monossido di carbonio, a sua volta, riduce gli ossidi di ferro in metallo puro. L’ossigeno è poi usato in una seconda fase della lavorazione del ferro nel convertitore di Bessemer, nel focolare aperto, o nel metodo del processo di base dell’ossigeno per convertire la “ghisa” in acciaio. In questa fase, l’ossigeno viene usato per reagire con l’eccesso di carbonio, silicio e metalli che rimangono nella ghisa e che devono essere rimossi per produrre acciaio.
Un’altra applicazione metallurgica dell’ossigeno è nelle torce usate per la saldatura e il taglio. Le due torce più comuni utilizzano la reazione tra ossigeno e idrogeno (torcia ossidrica) o tra ossigeno e acetilene (torcia ossiacetilenica). Entrambi i tipi di torcia producono temperature dell’ordine di 3.000°C (5.400°F) o più e possono quindi essere utilizzati per tagliare o saldare la grande maggioranza dei materiali metallici.
Sotto forma di LOX, l’ossigeno è ampiamente utilizzato come agente ossidante in molti tipi di razzi e missili. Per esempio, l’enorme serbatoio esterno necessario per sollevare lo Space Shuttle nello spazio contiene 550.000 litri (145.000 galloni) di ossigeno liquido e 1.500.000 litri (390.000 galloni) di idrogeno liquido. Quando questi due elementi reagiscono nei motori principali dello shuttle, forniscono una spinta massima di 512.000 libbre.
L’industria chimica usa grandi quantità di ossigeno ogni anno in una varietà di reazioni di sintesi chimica (formazione). Una delle più importanti è il cracking degli idrocarburi da parte dell’ossigeno. Nella maggior parte dei casi, il riscaldamento di un idrocarburo con l’ossigeno porta alla combustione, con anidride carbonica e acqua come prodotti principali. Tuttavia, se il tasso al quale l’ossigeno viene immesso in una miscela di idrocarburi è attentamente controllato, l’idrocarburo viene “spaccato”, o spezzato per produrre altri prodotti, come acetilene, etilene e propilene.
Vari tipi di combustibili sintetici possono anche essere prodotti con l’ossigeno come uno dei reagenti principali. Il gas di produzione, per esempio, è prodotto facendo passare l’ossigeno ad una velocità controllata attraverso un letto di carbone caldo o di coke. La maggior parte dell’anidride carbonica prodotta in questa reazione viene ridotta a monossido di carbonio in modo che il prodotto finale (il gas di produzione) consiste principalmente di monossido di carbonio e idrogeno.
Forse l’applicazione medica più conosciuta dell’ossigeno è l’ossigenoterapia, dove ai pazienti che hanno problemi di respirazione vengono date dosi di ossigeno puro o quasi puro. L’ossigenoterapia è spesso usata durante le procedure chirurgiche, durante il parto, durante il recupero da attacchi cardiaci e durante il trattamento di malattie infettive. In ogni caso, fornire a una persona ossigeno puro riduce lo stress sul suo cuore e sui suoi polmoni, accelerando il tasso di recupero.
L’ossigeno puro o l’aria arricchita di ossigeno possono anche essere forniti in ambienti dove la respirazione può essere difficile. Gli aerei che volano ad alta quota, naturalmente, sono sempre dotati di forniture di ossigeno in caso di problemi con la normale fornitura di aria della nave. Anche i subacquei di acque profonde portano con sé o si fanno pompare forniture di aria arricchita di ossigeno.
Alcuni impianti di purificazione dell’acqua e di trattamento delle acque reflue usano l’ossigeno. Il gas viene pompato attraverso l’acqua per aumentare la velocità con cui i batteri naturali scompongono i materiali organici di scarto. Un processo simile è stato trovato per ridurre la velocità con cui l’eutrofizzazione avviene in laghi e stagni e, in alcuni casi, per invertire effettivamente quel processo. (L’eutrofizzazione è la dissoluzione dei nutrienti in un corpo d’acqua. La crescita della vita vegetale acquatica e la diminuzione dell’ossigeno disciolto sono i due risultati principali del processo).
Infine, l’ossigeno è essenziale per tutta la vita animale sulla Terra. Una persona può sopravvivere alcuni giorni o settimane senza acqua o cibo, ma non più di pochi minuti senza ossigeno. In assenza di ossigeno, le reazioni chimiche che generano energia all’interno delle cellule si interromperebbero e la persona morirebbe.
Zolfo
Lo zolfo è un elemento non metallico che può esistere in molte forme allotropiche (forme fisicamente o chimicamente diverse della stessa sostanza). Le più familiari sono chiamate zolfo rombico e monoclino. Entrambi sono solidi giallo brillante con punti di fusione di circa 115°C (239°F). Una terza forma è chiamata zolfo plastico o amorfo. È un liquido brunastro prodotto quando lo zolfo rombico o monoclino è fuso.
Lo zolfo stesso non ha alcun odore. Ha una cattiva reputazione a questo proposito, tuttavia, perché alcuni dei suoi composti più comuni hanno odori forti. L’anidride solforosa, uno di questi composti, ha un effetto acuto, soffocante, su chiunque lo respiri. Il “fuoco e lo zolfo” della Bibbia era una delle peggiori punizioni che i suoi autori potessero immaginare. Lo zolfo in questa espressione si riferiva allo zolfo ardente, o diossido di zolfo. Il fatto che lo zolfo provenga dalle profondità della terra e che l’anidride solforosa possa essere sentita nei fumi dei vulcani ha ulteriormente alimentato l’immaginazione della gente su come deve essere l’inferno.
Un secondo composto dello zolfo con un cattivo odore è il solfuro di idrogeno. Il forte odore di uova marce è dovuto alla presenza di questo composto.
Occorrenza e preparazione. Lo zolfo è il sedicesimo elemento più abbondante nella crosta terrestre. Si presenta sia come elemento che in una varietà di composti. Come elemento può essere trovato in miniere sotterranee molto grandi, più comunemente lungo la costa del Golfo degli Stati Uniti e in Polonia e Sicilia. Lo zolfo viene estratto da queste miniere per mezzo del processo Frasch. In questo processo, il vapore surriscaldato è pompato attraverso il più esterno di una serie di tre tubi. L’aria compressa è forzata lungo il tubo più interno. Il vapore surriscaldato fa fondere lo zolfo sotterraneo e l’aria compressa lo spinge verso l’alto, attraverso il centro dei tre tubi, fino alla superficie terrestre.
Lo zolfo è anche ampiamente distribuito sotto forma di minerali e minerali. Molti di questi sono sotto forma di solfati, compreso il gesso (solfato di calcio, CaSO 4 ), la barite (solfato di bario, BaSO 4 ) e i sali di Epsom (solfato di magnesio, MgSO 4 ). Altri sono solfuri metallici, tra cui piriti di ferro (solfuro di ferro, FeS 2 ), galena (solfuro di piombo, PbS), cinabro (solfuro mercurico, HgS), stibnite (solfuro di antimonio, Sb 2 S 3 ), e zinco blenda (solfuro di zinco, ZnS). Lo zolfo viene recuperato da questi minerali metallici riscaldandoli fortemente in aria, che converte lo zolfo in anidride solforosa e libera il metallo puro. Poi l’anidride solforosa può andare direttamente nella produzione di acido solforico, che è dove più del 90% dello zolfo estratto nel mondo finisce.
Usi dello zolfo e dei suoi composti. Un po’ di zolfo è usato direttamente come fungicida e insetticida, in fiammiferi, fuochi d’artificio e polvere da sparo, e nella vulcanizzazione della gomma naturale (un trattamento che dà alla gomma elasticità e forza). La maggior parte, tuttavia, viene convertita in una moltitudine di composti utili.
L’acido solforico è di gran lunga il più importante di tutti i composti dello zolfo. Quasi il 90% di tutto lo zolfo prodotto viene convertito prima in anidride solforosa e poi in acido solforico. L’acido è costantemente al primo posto tra i prodotti chimici prodotti negli Stati Uniti. Nel 1990, più di 40 miliardi di chilogrammi (89 miliardi di libbre) di acido solforico sono stati prodotti, più del 50% in più rispetto al secondo prodotto chimico più popolare (gas di azoto). L’acido solforico è usato nella produzione di fertilizzanti, batterie per automobili, prodotti petroliferi, pigmenti, ferro e acciaio e molti altri prodotti.
Il ciclo dello zolfo. Come l’azoto, il carbonio e il fosforo, lo zolfo passa attraverso le parti gassose, liquide e solide del nostro pianeta in una serie di reazioni continue conosciute come il ciclo dello zolfo. Le fasi principali del ciclo dello zolfo sono illustrate nella figura allegata.
Lo zolfo è prodotto naturalmente come risultato delle eruzioni vulcaniche e attraverso le emissioni dalle sorgenti calde. Entra nell’atmosfera principalmente sotto forma di anidride solforosa, poi rimane nell’atmosfera in quella forma o, dopo aver reagito con l’acqua, sotto forma di acido solforico. Lo zolfo viene riportato sulla superficie terrestre come deposito acido quando piove o nevica.
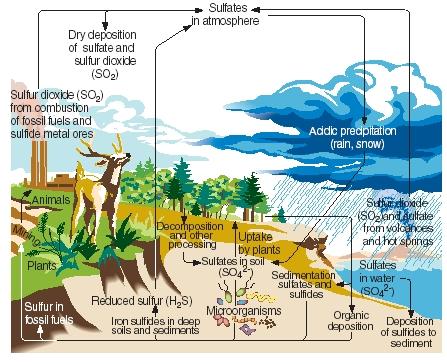
.)
Sulla superficie terrestre, l’anidride solforosa e l’acido solforico reagiscono con i metalli per formare solfati e solfuri. L’elemento è anche incorporato dalle piante in una forma conosciuta come zolfo organico. Alcuni aminoacidi, i composti da cui sono fatte le proteine, contengono zolfo. Lo zolfo organico delle piante viene alla fine passato agli animali che mangiano quelle piante. È, a sua volta, convertito dalle proteine vegetali alle proteine animali.
Quando le piante e gli animali muoiono, lo zolfo viene restituito al suolo dove viene convertito da microrganismi in solfuro di idrogeno. L’idrogeno solforato viene poi restituito all’atmosfera, dove viene ossidato in acido solforico.
Le attività umane influenzano il ciclo dello zolfo in vari modi. Per esempio, quando il carbone e i minerali metallici sono estratti, lo zolfo e i solfuri possono essere rilasciati e restituiti al terreno. Inoltre, la combustione di carbone, petrolio e gas naturale spesso rilascia anidride solforosa nell’atmosfera. Questa anidride solforosa si aggiunge alla quantità già presente da fonti naturali, aumentando notevolmente la quantità di precipitazioni acide che cadono sulla superficie terrestre. Alcune persone credono che le precipitazioni acide (o piogge acide) siano responsabili della morte degli alberi e di altre piante, dell’acidificazione dei laghi che ha danneggiato gli animali marini, dei danni alle strutture di metallo e pietra e di altri danni ambientali.
Selenio, tellurio e polonio
Selenio e tellurio sono entrambi elementi relativamente rari. Si collocano nell’ultimo dieci per cento di tutti gli elementi in termini di abbondanza. Tendono a presentarsi nella crosta terrestre in associazione con minerali di rame e altri metalli. Entrambi sono ottenuti come sottoprodotto della raffinazione elettrolitica del rame. Durante questo processo, affondano sul fondo della vasca di elettrolisi, dove possono essere rimossi dal fango che si sviluppa.
Il selenio si presenta in una varietà di forme allotropiche (forme fisicamente o chimicamente diverse della stessa sostanza), la più comune delle quali è una polvere rossa che diventa nera quando esposta all’aria. Il punto di fusione dell’elemento è 217°C (423°F) ed il suo punto di ebollizione è 685°C (1,265°F). Il tellurio è un solido bianco-argenteo che sembra un metallo (anche se è in realtà un metalloide). Il suo punto di fusione è 450°C (842°F) ed il suo punto di ebollizione è 990°C (1,814°F).
Il selenio ha un ruolo interessante negli organismi viventi. È essenziale in concentrazioni molto basse per mantenere la salute nella maggior parte degli animali. Infatti, viene spesso aggiunto ai mangimi per animali. In concentrazioni più elevate, tuttavia, l’elemento è stato trovato per avere effetti dannosi sugli animali, causando giovani deformi e adulti malati.
Gli usi principali del selenio sono nell’elettronica e nella fabbricazione di vetro colorato. Le macchine fotocopiatrici, le celle solari, le fotocellule, i tubi delle immagini televisive, i raddrizzatori e i relè elettronici (usati per controllare il flusso della corrente elettrica) usano tutti il selenio. Alcuni dei più bei vetri colorati, che vanno dal rosa pallido al rosso brillante, sono fatti con composti di selenio.
Anche piccole quantità di tellurio sono usate nella produzione di vetro colorato. Più del 90 per cento dell’elemento, tuttavia, va alla produzione di leghe di ferro e altri metalli.
Il polonio ha 27 isotopi, tutti radioattivi. Si trova naturalmente nei minerali di uranio, dove è il prodotto finale della lunga serie di reazioni con cui l’uranio subisce il decadimento radioattivo. È uno degli elementi più rari sulla terra, con un’abbondanza di non più di circa 3 × 10 -10 parti per milione. La scoperta del polonio nel 1898 dalla chimica polacco-francese Marie Curie (1867-1934) è una delle storie più drammatiche della storia della scienza. Ha lavorato tonnellate di minerale di uranio per ottenere pochi milligrammi del nuovo elemento, che ha poi chiamato come la sua patria, la Polonia. Il polonio trova un uso limitato in dispositivi di generazione di energia altamente specializzati, come quelli usati per i satelliti spaziali e le sonde spaziali.