Principi di biologia
Dopo aver imparato che le reazioni chimiche rilasciano energia quando i legami che immagazzinano energia vengono rotti, un’importante domanda successiva è la seguente: Come viene quantificata ed espressa l’energia associata a queste reazioni chimiche? Come si può confrontare l’energia rilasciata da una reazione con quella di un’altra reazione? Una misura dell’energia libera è usata per quantificare questi trasferimenti di energia. Ricordiamo che secondo la seconda legge della termodinamica, tutti i trasferimenti di energia comportano la perdita di una certa quantità di energia in una forma inutilizzabile come il calore. L’energia libera si riferisce specificamente all’energia associata a una reazione chimica che è disponibile dopo aver tenuto conto delle perdite. In altre parole, l’energia libera è energia utilizzabile, o energia che è disponibile per fare lavoro. Guardando questo concetto in senso biologico, l’energia libera è l’energia all’interno di una molecola che può essere usata per compiere lavoro. Il glucosio ha molta energia libera perché c’è molta energia immagazzinata nei legami della molecola di glucosio. L’anidride carbonica ha un’energia libera molto più bassa perché c’è molta meno energia immagazzinata nei suoi legami.
Se l’energia viene rilasciata durante una reazione chimica, allora il cambiamento di energia libera dalla conversione dei reagenti ai prodotti, indicato come ΔG (delta G) sarà un numero negativo. Un cambiamento negativo nell’energia libera significa anche che i prodotti della reazione hanno meno energia libera dei reagenti, perché rilasciano un po’ di energia libera durante la reazione. Le reazioni che hanno un cambiamento negativo nell’energia libera e di conseguenza rilasciano energia libera sono chiamate reazioni esergoniche. Pensa: esergonico significa che l’energia esce dal sistema. Queste reazioni sono anche chiamate reazioni spontanee, e i loro prodotti hanno meno energia immagazzinata dei reagenti. Una distinzione importante deve essere fatta tra il termine spontaneo e l’idea di una reazione chimica che avviene immediatamente. Contrariamente all’uso quotidiano del termine, una reazione spontanea non è quella che avviene improvvisamente o rapidamente. L’arrugginimento del ferro è un esempio di reazione spontanea che avviene lentamente, poco a poco, nel tempo.
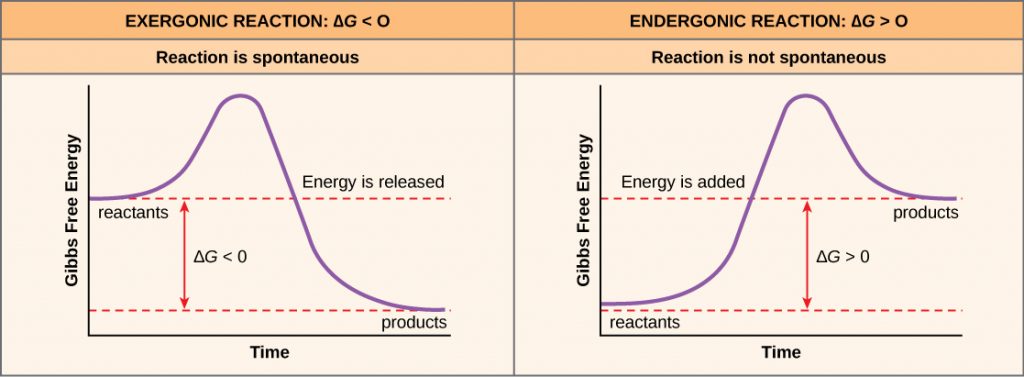
Se una reazione chimica assorbe energia piuttosto che rilasciare energia in equilibrio, allora il ΔG per quella reazione sarà un valore positivo. In questo caso, i prodotti hanno più energia libera dei reagenti. Così, i prodotti di queste reazioni possono essere pensati come molecole che immagazzinano energia. Queste reazioni chimiche sono chiamate reazioni endergoniche e non sono spontanee.
Una reazione endergonica non avrà luogo da sola senza l’aggiunta di energia libera.

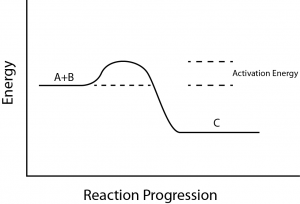
C’è un altro importante concetto che deve essere considerato riguardo alle reazioni endergoniche ed esergoniche. Le reazioni esergoniche richiedono una piccola quantità di energia per iniziare, prima di poter procedere con le loro fasi di rilascio di energia.
Queste reazioni hanno un rilascio netto di energia, ma richiedono comunque un certo input di energia all’inizio. Questa piccola quantità di energia necessaria perché tutte le reazioni chimiche avvengano è chiamata energia di attivazione (Figura 3).
Se non diversamente specificato, le immagini in questa pagina sono sotto licenza CC-BY 4.0 di OpenStax.
Testo adattato da: OpenStax, Concepts of Biology. OpenStax CNX. May 18, 2016 http://cnx.org/contents/[email protected]