好中球減少症
好中球減少症の原因となり得るものをすべて挙げていくと、きりがありません。 好中球減少症の病因は、概念的にはメカニズム別と病因分類別の2つに大別できます。
好中球減少症を引き起こすメカニズムは多様で、完全には理解されていません。 多くの場合、薬剤やその他の物質に長期間さらされた後に好中球減少症が発生し、低形成骨髄による好中球の産生が減少する。 これは幹細胞への直接的な毒性作用を示唆している。 他の症例では、繰り返されるが断続的な薬剤や他の物質への曝露が必要である。 このことは免疫機構を示唆しているが、この考えは証明されていない。
好中球減少症のメカニズムに関するこの不完全な理解を考慮すると、広範な病因分類による分類は保持するのがより単純である。 このスキーマでは,好中球減少症の病因は先天性(遺伝性)または後天性のいずれかに分類される。 この分類は臨床診断上の有用性は限られたものであるが,好中球減少症の遺伝的原因を後天性原因の一群から明確に分離するのに有用であろう。
多くの遺伝性疾患は、好中球エラスターゼ、ELA2をコードする遺伝子の変異に起因しています。 いくつかの対立遺伝子が関与しています。 最も一般的な変異は、イントロン4におけるスプライス部位を不活性化するイントロン置換である。 ELA2以外の遺伝子も関与している。
表1.ELA2が関与する遺伝的疾患の一覧です。 無顆粒球症の遺伝的条件(新しいウィンドウで表を開く)
|
Syndrome |
Inheritance |
Gene |
Clinical Features |
|
Cyclic neutropenia |
Autosomal dominant |
ELA2 |
Alternate 21-day cycling of neutrophils and monocytes |
|
Kostmann syndrome |
Autosomal recessive |
Unknown |
Stable neutropenia, no MDS or AML |
|
Severe congenital neutropenia |
Autosomal dominant |
ELA2 (35-84%) |
Stable neutropenia, MDS or AML |
|
Autosomal dominant |
GFI1 |
Stable neutropenia, circulating myeloid progenitors, lymphopenia |
|
|
Sex linked |
Wasp |
Neutropenic variant of Wiskott-Aldrich syndrome |
|
|
Autosomal dominant |
G-CSFR |
G-CSF–refractory neutropenia, no AML or MDS |
|
|
Hermansky-Pudlak syndrome type 2 |
Autosomal recessive |
AP3B1 |
Severe congenital neutropenia, platelet dense-body defect, oculocutaneous albinism |
|
Chediak-Higashi syndrome |
Autosomal recessive |
LYST |
Neutropenia, oculocutaneous albinism, giant lysosomes, impaired platelet function |
|
Barth syndrome |
Sex linked |
TAZ |
Neutropenia, often cyclic; cardiomyopathy, methylglutaconic aciduria |
|
Cohen syndrome |
Autosomal recessive |
COH1 |
Neutropenia, mental retardation, dysmorphism |
|
Source: Modified from Berliner et al, 2004. AML = acute myeloid leukemia; G-CSF = granulocyte colony-stimulating factor; MDS = myelodysplastic syndrome. |
|||
後天的好中球減少症の原因は複雑ですが、多くは次の三つの大きなカテゴリーに関連しています:感染、薬剤(直接毒性または免疫媒介)、自己免疫性です。 慢性良性好中球減少症,あるいは慢性特発性好中球減少症は,遺伝性と後天性の重複疾患であるように思われ,時に区別がつかないことがある。 ある好中球減少症患者は明確な病歴と家族性パターンを示すが、他の患者は家族歴がなく、血液検査の判定も少なく、好中球減少の期間も不明である。 この患者群は遺伝性あるいは後天性の好中球減少症である可能性がある。
免疫異常を伴う先天性好中球減少症
免疫グロブリン異常を伴う好中球減少症は、X連鎖性無ガンマグロブリン血症、孤立性免疫グロブリンA(IgA)欠損症、X連鎖性高免疫グロブリンM(XHIGM)症候群およびI型異ガンマグロブリン血症の個人で観察されます。 CD40リガンドの変異に起因するXHIGMでは、患者は実際にIgM値は正常または上昇しているが、血清IgG値は著しく低下していることがある。
網様体形成不全の患者は、重度の好中球減少、細胞媒介免疫の欠如、アガマグロブリン血症、およびリンパ球減少を示します。 生命を脅かす感染症は、顆粒球コロニー刺激因子(G-CSF)に抵抗性である。
先天性または慢性好中球減少症
重症先天性好中球減少症(SCN)、またはコストマン症候群は、最も頻繁に劣性遺伝によって引き起こされ、高い血縁度を持つ遠隔地の孤立した集団で発見されます。 常染色体優性遺伝および散発性の症例も報告されており、その多くはG-CSF受容体の変異に起因する。 本症候群には一様な遺伝的欠陥は存在しない。 周期性好中球減少症の原因であるELA2の変異(下記参照)は、Kostmann様SCNの表現型を説明するには十分ではない。
患者は生後3ヶ月までに再発性の細菌感染症を呈する。 口腔内と直腸周囲が最も多い感染部位である。 このタイプの好中球減少症は重症で、治療はG-CSFである。 G-CSF治療後にモノソミー7を持つ骨髄異形成症候群(MDS)/急性骨髄性白血病(AML)に移行するリスクは、追加の後天性突然変異と関連しています。 これらの症例の多くは、G-CSF受容体の変異によって引き起こされます。
他の形態のSCNを持つ患者の中には、造血幹細胞の機能と系統決定の決定に関与する亜鉛フィンガー転写抑制遺伝子であるGFI1に変異があるようです。
周期性好中球減少症(CN)は、感染に伴う好中球減少の周期的発作とその後の末梢好中球数回復が特徴です。 その周期性は約21日(範囲:12~35日)である。 骨髄系前駆細胞のアポトーシスが促進されるため、好中球が減少する前に顆粒球の前駆細胞が骨髄から消失します。 一部の症例は、常染色体劣性遺伝で決定されることがあります。 その他の症例は常染色体優性遺伝によるものである。
CNの散発例では、患者はELA2の突然変異を有していることがあります。 予後は良好で、経過は良性である。しかし、患者の10%は生命を脅かす感染症に罹患する。 周期性好中球減少症の治療は、毎日のG-CSFです。
慢性良性好中球減少症
家族性慢性良性好中球減少症、または良性民族性好中球減少は、アフリカ、イエメナイトユダヤ、エチオピアユダヤ、アラブ、カリブおよび西インド系に見られる常染色体優性遺伝のパターンの疾患である。 アフリカ系およびイエメナイト系ユダヤ人の祖先を持つ集団では、遺伝学的研究によりDARC遺伝子の一塩基多型との強い関連性が示されています。 患者は通常無症状で、感染症は軽度である。 慢性好中球減少症の罹患者は、全体的に感染症のリスクが低く、特別な治療も必要ありません。
非家族性の慢性良性好中球減少症では、良性の経過をたどる軽度の感染症がこの疾患を代表します。
特発性慢性好中球減少症
特発性慢性好中球減少症は除外診断である。
表現型異常を伴う好中球減少症
シュワックマン症候群(Shwachman-Diamond)は常染色体劣性遺伝のパターンがある。 好中球減少症は中等度から重度で,死亡率は15~25%であり,乳児期に感染症の再発,下痢,摂食困難などの症状を呈す症候群である。
シュワックマン-ダイヤモンド症候群とX連鎖性先天性角化不全症(DC)、軟骨毛低形成症(CHH)、ダイヤモンド-ブラックファン貧血(DBA)は、リボソーム合成に関わる共通の遺伝子欠損を持つようで、このような遺伝子欠損を持つ疾患はありません。 シュワックマン-ダイヤモンド症候群の多くは、SBDS遺伝子の変異によって引き起こされます。 この遺伝子の正確な機能はまだ解明されていませんが、リボソームの合成やRNAのプロセシング反応に関与しているとされています。 治療法はG-CSFです。
CHHでは、9番染色体上の常染色体劣性遺伝で、アーミッシュやフィンランドの家系に認められます。 CHHは、リボヌクレアーゼ・ミトコンドリアRNAプロセッシング(RNase MRP)複合体のRNA成分をコードするRMRP遺伝子の変異によって引き起こされます。 好中球減少症は中等度から重度です。 CHHは、細胞媒介性免疫の欠陥、大球性貧血、胃腸疾患、小人症を呈する。 また、癌、特にリンパ腫の素因を示す。
先天性角化不全症(Zinsser-Cole-Engman症候群)は、精神遅滞、汎血球減少、および細胞媒介免疫の欠損を示す。 先天性角化不全症は女性よりも男性に多く、血液学的にはファンコニー貧血に類似しています。
この疾患のX連鎖劣性型は、リボ核タンパク質粒子に関連する核小体タンパク質であるジスケリンをコードするDKC1の変異に関連していることが知られています。 常染色体優性遺伝の場合は、テロメラーゼの一部であるTERCという別の遺伝子の変異が関連している。 テロメラーゼはタンパク質とRNAの両成分を持ち、TERCはRNAの部分をコードしている。 この疾患の患者さんは、通常よりもテロメアが短くなっています。
バルト症候群はX連鎖性劣性疾患で、幼児期の心筋症、骨格筋障害、反復性感染症、小人症、中等度から重度の好中球減少症がみられます。
チェディアック・ヒガシ症候群は、常染色体劣性疾患で、再発性感染症、精神遅滞、羞明、眼振、眼皮膚アルビニズム、神経障害、出血障害、歯肉炎、様々な細胞におけるリソソーム顆粒を呈する。 好中球減少症は中等度から重度で、治療は骨髄移植です。
骨髄異形成
骨髄異形成は乳児期に中等度の好中球減少を示し、再発性感染症に関連しています。 この症状は、好中球前駆体におけるアポトーシスの促進およびbcl-xの発現低下によるものである。 核の異常な外観は、核のストランドを伴う過分割、ピクノーシス、細胞質の空胞化が観察される。 治療はG-CSFとGM-CSFです。
Lazy leukocyte syndrome
怠惰な白血球症候群は、関連する好中球の運動異常と重度の好中球減少症である。
代謝異常
これらは変動する好中球を伴う慢性的な好中球減少症である。 They include glycogen storage disease type 1b and various acidemias, such as isovaleric, propionic, and methylmalonic. In glycogen storage disease type 1b, the treatment is G-CSF and GM-CSF.
Acquired neutropenia caused by intrinsic bone marrow disease
Intrinsic bone marrow diseases that may cause neutropenia include the following:
-
Aplastic anemia
-
Hematologic malignancy (eg, leukemia, lymphoma, myelodysplasia, myeloma)
-
Ionizing radiation
-
Tumor infiltration
-
Granulomatous infection
-
Myelofibrosis
Immune-mediated neutropenia
A drug may act as a hapten and induce antibody formation. This mechanism operates in cases due to gold, aminopyrine, and antithyroid drugs. The antibodies destroy the granulocytes and may not require the continued presence of the drug for their action. Alternatively, the drug may form immune complexes that attach to the neutrophils. This mechanism operates with quinidine.
Drug immune-mediated neutropenia may be caused by the following:
-
Aminopyrine
-
Quinidine
-
Cephalosporins
-
Penicillins
-
Sulfonamides
-
Phenothiazines
-
Hydralazine
Other medications have been implicated
Autoimmune neutropenia is the neutrophil analogue of autoimmune hemolytic anemia and of idiopathic thrombocytopenic neutropenia. It should be considered in the absence of any of the common causes. Antineutrophil antibodies have been demonstrated in these patients. Autoimmune neutropenia may be associated with the following:
-
Rheumatoid arthritis (with or without Felty syndrome)
-
Sjögren syndrome
-
Chronic, autoimmune hepatitis
-
Systemic lupus erythematosus
-
Thymoma
-
Goodpasture disease
-
Granulomatosis with polyangiitis (Wegener granulomatosis)
-
Pure red blood cell (RBC) aplasia, in which there is complete disappearance of granulocyte tissue from the bone marrow; pure RBC dysplasia is a rare disorder due to the presence of antibody-mediated, granulocyte-macrophage colony forming unit (GM-CFU) inhibitory activity, and it is often associated with thymoma
-
Transfusion reactions, which can be caused by the surface antigens of neutrophilia; 顆粒球輸血を繰り返した患者は同種免疫になる可能性がある
-
大顆粒リンパ球増殖または白血病
自己免疫性新生児好中球減少症では、母親が胎児の好中球抗原に対してIgG抗中球抗体を作り、非自己として認識されています。 これは生児出産の3%に起こります。 この疾患は、新生児期の発熱、尿路感染、蜂巣炎、肺炎、敗血症として現れる。 好中球減少の期間は通常7週間です。
慢性自己免疫性好中球減少症は成人でも観察され、年齢による優先順位はありません。 患者の36%が血清抗好中球抗体を示し、臨床経過は通常、それほど重篤ではありません。 全身性エリテマトーデス、関節リウマチ、ウェゲナー肉芽腫症、および慢性肝炎に関連してこの疾患を持つことがあります。
慢性自己免疫性好中球減少症がこれらの疾患に関連している場合、治療として副腎皮質ステロイドが適応となります。 新生児および小児では、この疾患は感染症のリスクが低く、中耳、消化管、および皮膚を含む感染症も軽度です。
T-γリンパ球症、またはリンパ増殖性疾患は、CD3+ Tリンパ球またはCD3-ナチュラルキラー(NK)細胞が骨髄および組織に浸潤するクローン性疾患です。 大顆粒リンパ球の白血病(LGL-白血病)としても知られ、Tガンマリンパ球症は関節リウマチを伴うことがあり、高力価の抗好中球抗体を伴います。 好中球減少症は持続的で重篤です。 治療は多くの場合支持療法ですが、クローン集団を排除することにも向けられます。
感染症による後天性好中球減少症
感染症は後天性好中球減少症の最も一般的な形態です。 好中球減少症を引き起こす可能性のある感染症には、以下のものが含まれるが、これらに限定されない。
-
Bacterial sepsis
-
Viral infections (eg, influenza, measles, Epstein Barr virus , cytomegalovirus , viral hepatitis, human immunodeficiency virus -1) (see first image below)
-
Toxoplasmosis
-
Brucellosis
-
Typhoid
-
Tuberculosis (see second and third images below)
-
Malaria
-
Dengue fever
-
Rickettsial infection
-
Babesiosis
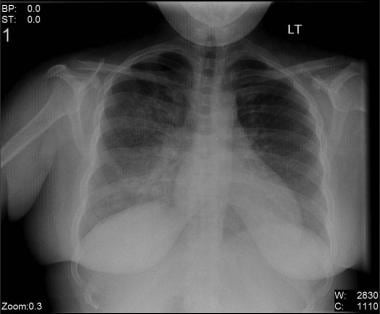 Bilateral interstitial infiltrates in a 31-year-old patient with influenza pneumonia.
Bilateral interstitial infiltrates in a 31-year-old patient with influenza pneumonia. 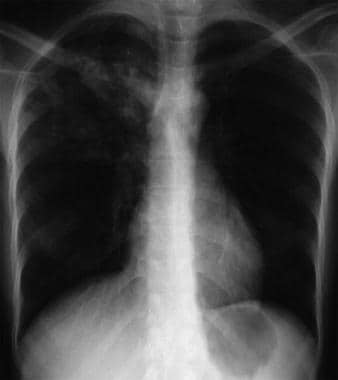 Anteroposterior chest radiograph in a young ED patient presenting with cough and malaise. The radiograph shows a classic posterior segment right upper lobe density consistent with active tuberculosis. この女性は隔離入院し、救急外来で経験的に4剤併用療法が開始された。 結核は喀痰検査で確認された. 画像提供:Remot Medicine, remotemedicine.org.
Anteroposterior chest radiograph in a young ED patient presenting with cough and malaise. The radiograph shows a classic posterior segment right upper lobe density consistent with active tuberculosis. この女性は隔離入院し、救急外来で経験的に4剤併用療法が開始された。 結核は喀痰検査で確認された. 画像提供:Remot Medicine, remotemedicine.org. 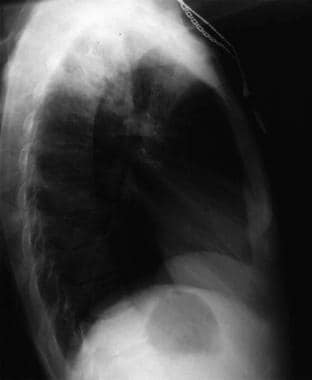 インフルエンザ肺炎の31歳患者の胸部側面X線写真である。 画像提供:Remote Medicine, remotemedicine.org.
インフルエンザ肺炎の31歳患者の胸部側面X線写真である。 画像提供:Remote Medicine, remotemedicine.org.
最もよく関与するのは、内因性細菌叢からの細菌です。 黄色ブドウ球菌は、皮膚感染症の症例で発見されます。 グラム陰性菌は、尿路および消化管の感染症で観察され、特に大腸菌およびシュードモナス種が挙げられます。 カンジダ・アルビカンス感染症も発生することがあります。
ウイルス感染症は、しばしば軽度または中等度の好中球減少を引き起こします。 無顆粒球症はまれですが、起こることがあります。 最も一般的な菌は、エプスタイン・バー・ウイルス、B型肝炎ウイルス、黄熱病ウイルス、サイトメガロウイルス、およびインフルエンザである。
栄養不足による後天性好中球減少症
好中球減少症を引き起こす可能性のある栄養不足は、ビタミンB-12、葉酸、銅欠乏を含みます。
細胞毒性化学療法以外の薬剤や化学物質による後天性好中球減少症
多くの薬剤は好中球減少症と関連しています。 最もリスクの高いカテゴリーは、抗甲状腺薬、マクロライド、プロカインアミドです。 上記のように,多くの薬剤は免疫を介した機序で作用する。 しかし,いくつかの薬剤は骨髄幹細胞または有糸分裂区画の好中球前駆体に直接毒性を示すようである。 例えば、抗精神病薬や抗うつ薬、クロラムフェニコールなどの薬物は、このように代謝や感受性に基づいて、ある個体では直接毒物として作用する可能性がある。 その他の薬物は、免疫機構と非免疫機構を併せ持つ場合や、作用機序が不明な場合がある。
抗菌薬には、ペニシリン、セファロスポリン、バンコマイシン、クロラムフェニコール、ゲンタマイシン、クリンダマイシン、ドキシサイクリン、フルシトシン、ニトロフラントイン、ノバイオシン、ミノサイクリン、グリセオフルビン、リンコマイシン、メトロニダゾール、リファンピン、イソニアジド、ストレプトマイシンがあります。 チアセタゾン、メベンダゾール、ピリメタミン、レバミソール、リストセチン、スルホンアミド、クロロキン、ヒドロキシクロロキン、キナクリン、エタンブトール、ダプソン、シプロフロキサシン、トリメトプリム、イミペネム/シラスタチン、ジドブジン、フルダラビン、アシクロビル、テルビナフィンなど。
鎮痛剤および抗炎症剤としては、アミノピリン、ジピロン、インドメタシン、イブプロフェン、アセチルサリチル酸、ジフルニサル、スリンダック、トルメチン、ベノキサプロフェン、バルビツール酸系、メサラジン、キニーネなどが挙げられる。
抗精神病薬、抗うつ薬、神経薬としては、フェノチアジン系薬剤(クロルプロマジン、メチルプロマジン、メパジン、プロマジン、チオリダジン。 prochlorperazine, trifluoperazine, trimeprazine)、clozapine、risperidone、imipramine、desipramine、diazepam、chlordiazepoxide、amoxapine、meprobamate、thiothixene、haloperidolなどです。
抗けいれん剤には、バルプロ酸、フェニトイン、トリメタジオン、メフェニトイン(メサントイン)、エトスキシミド、カルバマゼピンなどがあります。
抗甲状腺薬には、チオウラシル、プロピルチオウラシル、メシマゾール、カルビマゾール、過塩素酸カリウム、チオシアン酸塩などがあります。
心血管系薬剤としては、プロカインアミド、カプトプリル、アプリンジン、プロプラノロール、ヒドラジン、メチルドパ、キニジン、ジアゾキシド、ニフェジピン、プロパフェノン、チクロピジン、ベスナリノンなどがある。
抗ヒスタミン薬としては、シメチジン、ラニチジン、トリペレナミン(ピリベンザミン)、メタフェニレン、テナリジン、ブロムフェニラミン、ミアンセリンなどがある。
利尿薬としては、アセタゾラミド、ブメタニド、クロロチアジド、ハイドロクロロチアジド、クロルタリドン、メタゾラミド、スピロノラクトンなどがある。
血糖降下剤にはクロルプロパミド、トルブタミドなどがあります。
抗マラリア薬にはアモジアキン、ダプソン、ヒドロキシクロロキン、ピリメタミン、キニーネなどがあります。
その他の薬剤としては、アロプリノール、コルヒチン、アミノグルテチミド、ファモチジン、ベザフィブラート、フルタミド、タモキシフェン、ペニシラミン、レチノイン酸、メトクロプラミド、フェニンジオン、ジニトロフェノール、エタクリン酸。 ジクロロジフェニルトリクロロエタン(DDT)、シンチョウフェン、アンチモン、ピリチジオン、ラウルフィア、エタノール、クロルプロパミド、トルブタミド、チアジド、スピロノラクトン、メタゾラミド、アセタゾラミド、IVIG、レボドパなど。
重金属には金、ヒ素、水銀が含まれます。
薬剤や化学物質への曝露は無顆粒球症の最も一般的な原因です:患者の約半数が薬剤や化学物質への曝露歴を持っています。 骨髄を抑制し、低形成または無形成を引き起こす可能性のある化学物質や薬剤はすべて、無顆粒球症を引き起こす可能性がある。 ある種の薬剤は、十分な量を投与すれば誰にでも起こるものです。
一部の薬剤(例えばバルプロ酸、カルバマゼピン、βラクタム系抗生物質)は、骨髄造血を直接阻害することによって作用します。 骨髄培養において、これらの薬剤は用量に関係なく顆粒球のコロニー形成を阻害する。
無顆粒球症に関連する多くの薬剤が、米国食品医薬品局(FDA)の有害事象報告義務に基づき報告されています。 また、米国医師会(AMA)が管理するレジストリにも多くの薬剤が報告されています。 報告された薬剤は、単独、毒性のあることが知られている他の薬剤との併用、毒性の知られていない他の薬剤との併用で使用されたものである。 いくつかの薬剤は、無顆粒球症との関連頻度が高いので、特に注目されている。 それらは以下の通りである。
-
Phenothiazine
-
Antithyroid drugs (thiouracil and propylthiouracil)
-
Aminopyrine
-
Chloramphenicol
-
Sulfonamides
Miscellaneous immunologic neutropenias
Immunologic neutropenias may occur after bone marrow transplantation and blood product transfusions.
Felty syndrome is a syndrome of rheumatoid arthritis, splenomegaly, and neutropenia. Splenectomy shows an initial response, but neutropenia may recur in 10-20% of patients. Treatment is directed toward rheumatoid arthritis.
In complement activation–mediated neutropenia, hemodialysis, cardiopulmonary bypass, and extracorporeal membrane oxygenation (ECMO) expose blood to artificial membranes and can cause complement activation with subsequent neutropenia.
In splenic sequestration, the degree of neutropenia resulting from this process is proportional to the severity of the splenomegaly and the bone marrow’s ability to compensate for the reduction in circulating bands and neutrophils.
Eosinopenia and basophilopenia
Eosinopenia may be associated with the following:
-
Acute bacterial infection
-
Glucocorticoid administration
-
Physical stress
-
Thymoma
Decreased circulating basophils may be associated with the following:
-
Anaphylaxis
-
Acute infection
-
Drug-induced hypersensitivity
-
Congenital absence of basophils
-
Hemorrhage
-
Hyperthyroidism
-
Ionizing radiation
-
Neoplasia
-
Ovulation
-
Urticaria
-
Drugs (eg, corticosteroid, adrenocorticotropic hormone therapy, chemotherapeutic agents, thyroid hormones)
Go to Pediatric Autoimmune and Chronic Benign Neutropenia for complete information on this topic.
 Bilateral interstitial infiltrates in a 31-year-old patient with influenza pneumonia.
Bilateral interstitial infiltrates in a 31-year-old patient with influenza pneumonia.  Anteroposterior chest radiograph in a young ED patient presenting with cough and malaise. The radiograph shows a classic posterior segment right upper lobe density consistent with active tuberculosis. この女性は隔離入院し、救急外来で経験的に4剤併用療法が開始された。 結核は喀痰検査で確認された. 画像提供:Remot Medicine, remotemedicine.org.
Anteroposterior chest radiograph in a young ED patient presenting with cough and malaise. The radiograph shows a classic posterior segment right upper lobe density consistent with active tuberculosis. この女性は隔離入院し、救急外来で経験的に4剤併用療法が開始された。 結核は喀痰検査で確認された. 画像提供:Remot Medicine, remotemedicine.org.  インフルエンザ肺炎の31歳患者の胸部側面X線写真である。 画像提供:Remote Medicine, remotemedicine.org.
インフルエンザ肺炎の31歳患者の胸部側面X線写真である。 画像提供:Remote Medicine, remotemedicine.org.