痛風 危険因子、診断、治療
痛風は非常に痛く、無力なものですが、ほとんどすべての患者さんで治療が可能です。 痛みや合併症を避けるために、早期に発見し治療することが重要です。 痛風は足における大きな問題ですが、他の多くの関節を巻き込むこともあります。
- はじめに
- 誰が痛風になるのか、なぜなるのか
- どの関節が痛風関節炎になるのか、なぜ足で最もよく起こるのか
- 痛風の発作はどのように見え、感じるのか
- 痛風はどのようなものか
- 痛風はどのようなものか
- 痛風はどのようなものか
はじめに
痛風は、特に関節と腎臓における尿酸の沈着と関連する古代の病気です。
エジプト人は「gout」という言葉が使われる前、紀元前2640年に特定の病気として足の局所、母指に痛みを識別しました。 ヒポクラテスは、この病気について、男女比が高いことと、アルコールとの関連性を指摘しました。 また、トーマス・シデナム博士(1624-1689)は、痛風で見られる尿酸の塊(トフィと呼ばれる)を自らの体験に基づいて説明した。 しかし、19世紀初頭まで、痛風は他の炎症性関節炎とうまく区別されていませんでした。
痛風は非常に痛くてつらい病気ですが、ほとんどの患者さんで治療が可能です。 外反母趾が最も多く、中足、足首、膝にもよく見られます(痛風がこれらの関節や他の関節にどのように関わるかについては、下記3をご参照ください)
痛みや合併症を避けるために、早期に発見し治療することが重要です。
アルコールが痛風発作を引き起こすこともありますが、痛風になる人を決めるのはアルコールよりも遺伝の方がはるかに重要で、アルコールを飲まない人でも痛風になる人は大勢います。 これは、鉛が腎臓を傷つけ、尿酸を体外に排出する働きを阻害するためです。 最近では、鉛の入ったラジエーターで作られた「密造ウイスキー」を飲んだ人が、鉛中毒による痛風(「サトルネ痛風」)を発症したことがある。 また、体重の増加も痛風に関係している。 痛風を患う裕福で太ったブルガーは、19世紀のヨーロッパの古典的なイメージですが、実際には痛風はあらゆる経済階級の人々に影響を及ぼします。
痛風はありふれた病気であり、米国には500万人もの痛風患者がいると推定されている。 より控えめな推定では、この数は200万人以上とされています(メイヨー・クリニック推定)。 メイヨークリニックと台湾の両方の人口調査から、痛風の有病率が1990年代初期と比較して最近著しく増加していることがわかりました。
痛風の有病率は高齢者と若年者の両方で増加しています。若年者の増加は説明されていませんが、高齢者の増加は、少なくとも部分的には、寿命の延長、体重の増加(肥満は痛風と関連しています)、利尿剤の使用の増加に関連しています。
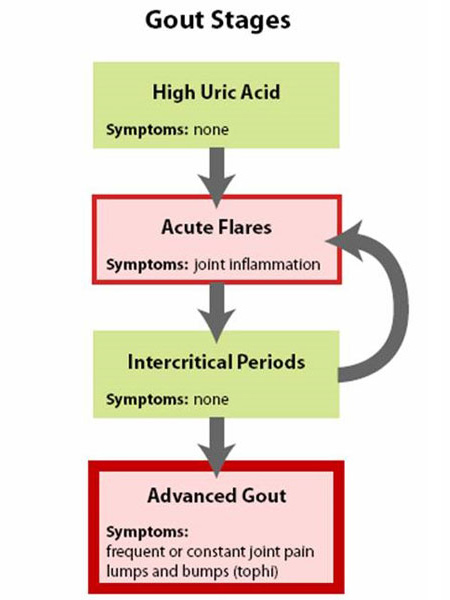
Figure 1: Stages of Gout
![]()
![]()
Figure 2A and B.は痛風のステージの図です。 正常な足指(A)と痛風を伴う足指(B)
痛風は4つの段階があると考えるとわかりやすいでしょう(図1:痛風の段階)。
- 第一段階は痛風や腎臓結石のない尿酸上昇で、症状がなく、一般に治療されない段階です。
- 第二段階は「急性発作」で、痛みや炎症があります。
- 第三段階は「発作と発作の間」で、正常と感じますが、再発の危険があります。
- 最終段階は「慢性痛風関節炎」で、尿酸の「塊」であるトフィ(図2a、2b:正常な足指関節と痛風トフィのイラスト)があり、急性痛風発作が頻繁に起こり、発作の間にもある程度の痛みがあることが多いです(図3:痛風の進行度)。
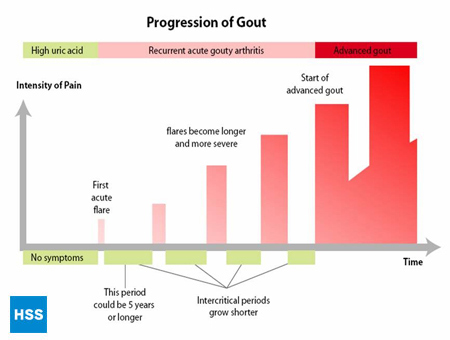
図3 痛風の進行
(記事の先頭へ戻る)
誰が、なぜ痛風になるのか
痛風には明らかに尿酸の蓄積が関与しています。
図4は、左側にプリン体から尿酸への経路を簡略化して示し、右側に痛風の治療薬がどのように作用するかを示しています(図4:プリン体から尿酸への経路)。 検査機関によって異なりますが、尿酸の正常値は3.6mg/dLから8.3mg/dLです。
人間と類人猿以外の哺乳類では、ウリカーゼという酵素が尿酸をより溶けやすいアラントインに分解し、尿中に排泄しやすくしているのです。 この酵素を持たないヒトは、尿酸値が高くなり、痛風になりやすい。
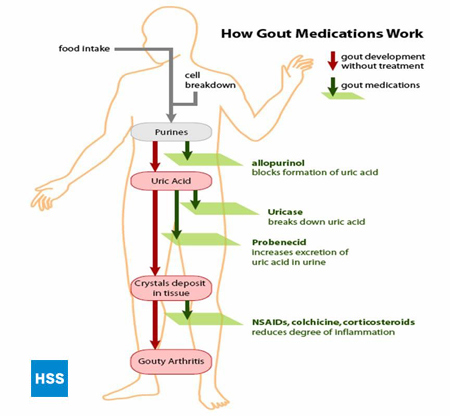
図4:プリン体から尿酸への経路
人が痛風になってしまうのは、尿酸が過剰に作られてしまう場合と尿に十分に出すことができない場合が(あるいは両方)あるためです。 痛風の最も一般的な原因(約90%)は、尿中に十分な尿酸が排泄されないことです。 この尿酸排泄不全は、さまざまな理由で起こります。 最も多いのは、腎臓の有機アニオントランスポーターと呼ばれる物質の遺伝子異常で、腎臓からの尿酸の再吸収が過剰になり、血液中の尿酸が過剰になるものである。 しかし、利尿剤、低用量アスピリン、アルコールなどの薬物によっても尿酸の排泄障害が起こることがあります。
痛風の約10%は、尿酸の過剰分泌が原因です。 尿酸が過剰に作られると、血液中だけでなく尿中にも多く含まれるようになり、痛風と腎臓結石の両方のリスクが高くなります。 プリン体分解経路の酵素に遺伝的な欠陥があり(図4参照)、この経路が過剰に活性化することで尿酸が過剰に生成される人がいる。 細胞にはDNAがあり、DNAにはプリン体が含まれているため、体内の細胞の分解を促進するものは尿酸を増やし、痛風につながる可能性があります。
食品もまた、プリン体を多く含む肉や肉汁、ビールなど、尿酸の過剰産生につながる可能性があります。 発症年齢は40~60歳が最も多い。 女性では閉経を迎えるまで痛風はかなりまれです。 エストロゲンが腎臓の陰イオン交換輸送体(上記参照)を阻害し、尿中に多くの尿酸を排泄させ、血中の尿酸濃度を下げるという説がある。 痛風は40代から60代で発症することが多いのですが、遺伝的素因がある人は40代より早く発症し、80代で初めて発症することもあります。
怪我がきっかけで痛風発作が起こる場合もあります。
尿酸値が上昇するメカニズムが何であれ、痛風では尿酸の結晶が関節液に移動することが重要なのです。 白血球(好中球)をはじめとする体の防御機構が尿酸結晶を取り込み、熱、赤み、腫れや痛みなど、あらゆる炎症の兆候を引き起こす炎症性化学物質(サイトカインと呼ばれる)が放出されることになるのです。
痛風について考えるとき、有用なモデルがWortmannによって提案されています1。尿酸結晶は、静かに置いておくことも、火をつけることもできるマッチのようなものと考えることができます。 結晶は軟骨や関節液の中に何年も存在し、炎症を起こすことはありません。 しかし、ある時、結晶の数が増えるなどして、マッチに火がつき、炎症が始まるのです。 この例えは、関節内の尿酸結晶を概念化する上でも、炎症を攻撃するもの(火のついたマッチに水をかける)、尿酸結晶を除去するもの(マッチを取る)、様々なタイプの痛風治療(下記参照)を理解する上でも重要なことです。
(記事の先頭へ)
痛風関節炎に関係する関節はどこか、なぜ足に多いのか
他のすべての既知の関節炎と同様、痛風にも攻撃しやすい特定の関節があり、足は痛風の最も多い場所である。 痛風が特に好むのは、第1中足趾節関節と呼ばれる外反母趾の関節で、75%の患者さんが最初に関わり、最終的には90%以上の患者さんがこの関節を傷つけます。 (図5 痛風の発作が起こる場所)。 この関節は、歩いたり走ったりするときに、1平方インチあたり何ポンドもの圧力を受ける関節であるため、痛風に特に関与していると考えられています。 また、足首、中足部、膝、肘の上にある滑液包なども痛風の好発部位とされています。 痛風が進行すると、指や手首など複数の関節が侵されることがあります。 肩関節が痛風に侵されることは非常にまれで、股関節は基本的に侵されません。
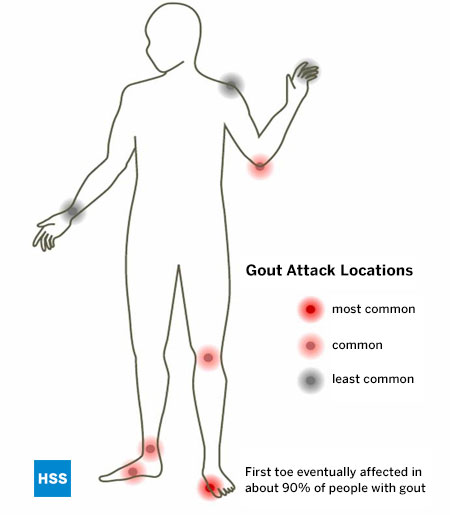
図5:痛風発作の起こる場所
痛風発作はどのように見え、どのように感じられるのでしょうか?
痛風が起こると、関節は非常に痛み、温かく、赤く、腫れる傾向があります(図6:痛風の急性発作を起こした足指)。 痛風発作に伴う炎症は全身に及ぶため、発熱や悪寒、倦怠感などが見られることも少なくありません。
![]()
図6 痛風発作の足指
痛風発作は、見た目には普通の関節でも、尿酸が付着して見えやすい関節でも起こることがあります。 これらの沈着はトフィと呼ばれます(図参照)。 図7a、7b:足とアキレス腱の上、図8:肘の上、図9:手の上、図10:指の大きな上)、多くの場所にできますが、特に足と肘に多く見られます。 図9の右手小指は、尿酸の結晶が無数にあるため、液体を除去した後、包帯を巻いています。
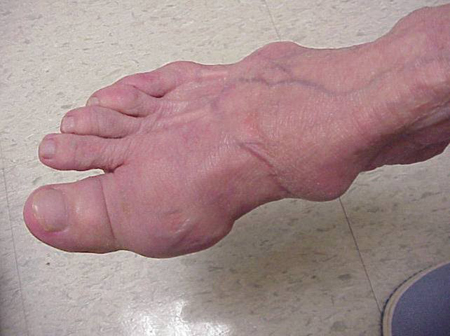
Figure 7a: Tophi on Foot
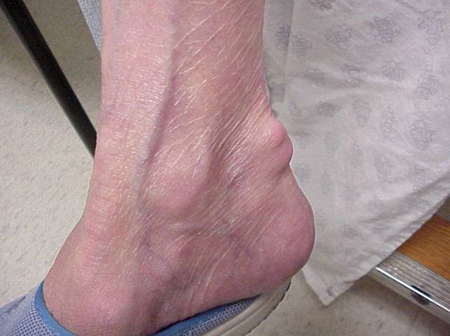
Figure 7b: Tophus on a Foot
足裏にできたトフィの写真。 アキレス腱上のtophus
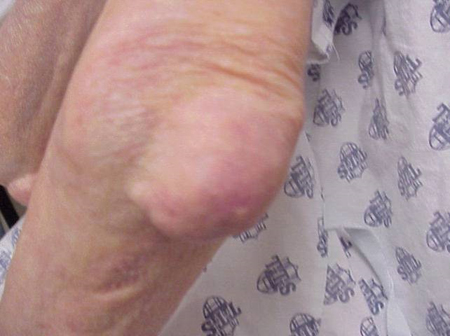
Figure 8: 肘のトポス
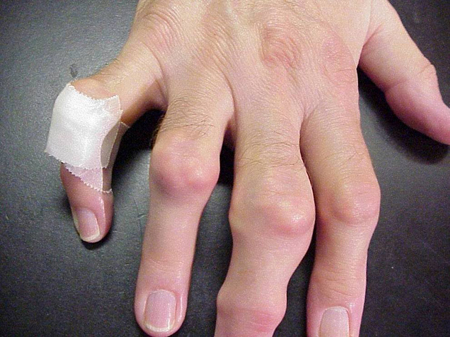
Figure 9: Tophi on Hands
![]()
Figure 10: Tophis on elbow トポス。
痛風発作の中にはすぐに治るものもありますが、大部分は1週間、数週間、あるいはもっと長く続きます。
(記事の先頭へ)
痛風はどのように診断するのですか
痛風の治療は一生続くので、確定診断をすることは非常に重要です。
理想的には、関節液や尿酸の塊(トフス)の中に尿酸の結晶を確認することで診断されます。 関節液をスライドに一滴垂らして、尿酸結晶の光の曲がり方を利用した偏光顕微鏡で観察することで確認することができます。 リウマチ専門医でなくても、可能であれば、小さな針で関節液を吸引して取り出し、ラボに送って分析することができます。 リウマチの専門医であれば、顕微鏡に偏光アタッチメントを備えていることが多いようです。 痛風の結晶は針のような形をしており、スライド上の並び方によって黄色や青色に見えます(図11:偏光顕微鏡による尿酸結晶の観察参照)。
![]()
図11 偏光顕微鏡による尿酸結晶
いくら理想でも液体や他の検体を調べることはできないが、痛風の診断はしなければならない状況はたくさんある。 このような状況下で痛風の診断を行うために、一連の基準が設定されている(表1-結晶同定が不可能な場合の痛風の診断参照)2
これらの基準は、関節リウマチなどの他のタイプの炎症性関節炎と異なる痛風の特徴を活かしている。 例えば、痛風の炎症は24時間以内に最大になる傾向がありますが、他のタイプの関節炎はもっとゆっくり進行する傾向があります。 また、関節が赤くなる、外反母趾がある、血中尿酸値が高いなどの特徴も痛風の可能性が高いとされています。
表1.痛風の診断基準
に示す10項目のうち、6項目が該当すると痛風と診断されます。 結晶の識別が不可能な場合の痛風の診断 理想的には、以下の10の特徴のうち6つが存在することになります:
- 炎症が1日以内に最大に達する(炎症の急速な加速)
- 同様の炎症のエピソードの既往がある
- 単一の関節における関節炎の発作
- 。
- 関節の発赤(痛風は炎症が強い)
- 片側の母趾の付け根(痛風の最も多い部位)の炎症
- 足の中央部の関節の炎症
- 血液検査での尿酸値上昇
- X線所見の関節の腫れが対称でない
- 関節液は感染の検査を受けて陰性であること
- 関節の腫れ
- のような関節の腫れ。
- X線検査では、骨内の嚢胞やびらんを含む痛風に特徴的な変化が見られる。
痛風の診断がついたら、痛風の合併症について評価する必要があります:
- 尿酸の集まり(トフィ)を探す必要があり、それは多くの場所にあります(図7~10を参照)。痛風と腎臓結石のある患者は、結石のない患者よりも迅速かつ積極的な尿酸値の低下(下記参照)を必要とし、結石の再発を予防しようとするからである。
- 痛風患者は冠動脈疾患のリスクが高いことが幅広い研究で示されており、冠動脈リスクに適した評価(たとえば、コレステロールやトリグリセリド値の検査)を受ける必要があります3
痛風による骨の損傷を診断することは重要であり、文書による損傷があれば、長期治療(下記参照)の明確な指標となります。 損傷が始まったら、全身の尿酸値を下げることが重要で、平衡化により、尿酸が関節から外に出ていくようになります。 これは、血液中の尿酸濃度と関節の尿酸濃度が、ある一定の値で「定常状態」と呼ばれるレベルに達するからです。 血中濃度が低下すれば、関節の尿酸値も徐々に低下していきます。
全身の尿酸を下げるには、さまざまなアプローチがあります。
体内の尿酸を下げるには、さまざまな方法があります。体内での尿酸の生産を減らしたり(たとえば、アロプリノール、下記参照)、尿酸の排泄を増やす(たとえば、プロベネシド、下記参照)ことが可能です。 また、結晶は体内で分解されますが(後述の7a:ラスブリカーゼ、7b:ペギル化ウリカーゼ参照)、このメカニズムを利用することは現在まだ研究中です。
痛風の画像診断としては、X線が標準的です(図12~17参照)。 図12:第1趾基部の痛風、図13:遠位指関節の痛風、図14:第1趾基部の痛風性変化と軟部組織の石灰化、図15:複数の指関節の痛風性破壊、図16:肘関節近位部の痛風性びらん、図17:肘関節近位部の痛風性びらん、図18:肘関節近位部の痛風性びらんを参照。 図18:痛風性軟部組織塊を示す膝のMRI)や超音波検査(図19:第1趾の付け根に痛風性炎症を示すパワードップラー検査)が有用である。
![]()
図12: Gout of the Base of the 1st Toe
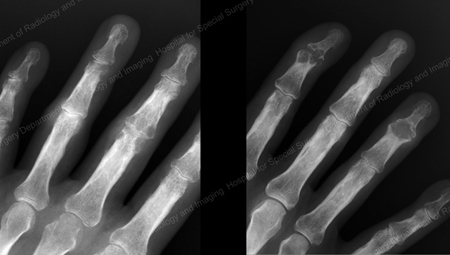
Figure 13: Gout of the Distal Finger Joints
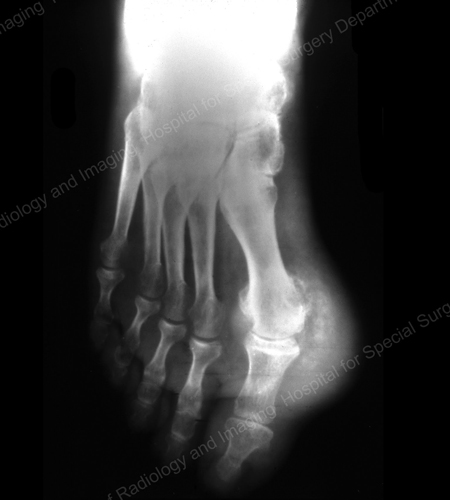
Figure 14: Gouty Change and Soft Tissue Calcification about the Base of the 1st Toe
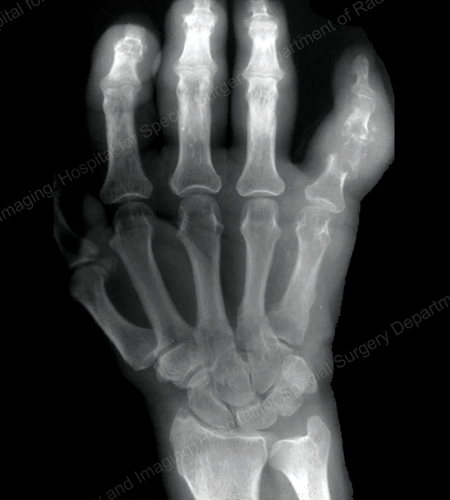
Figure 15: Gouty Destruction at Multiple Finger Joints
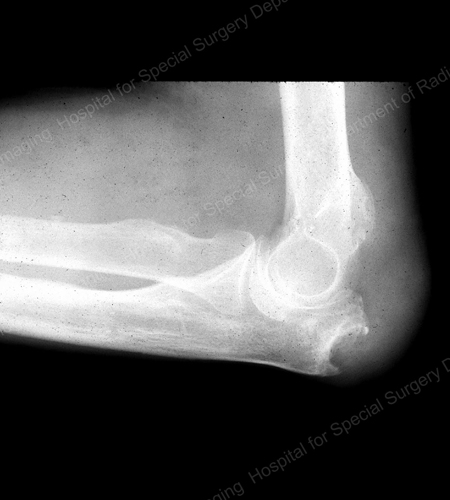
Figure 16: Gouty Erosion at the Proximal Ulna at the Elbow
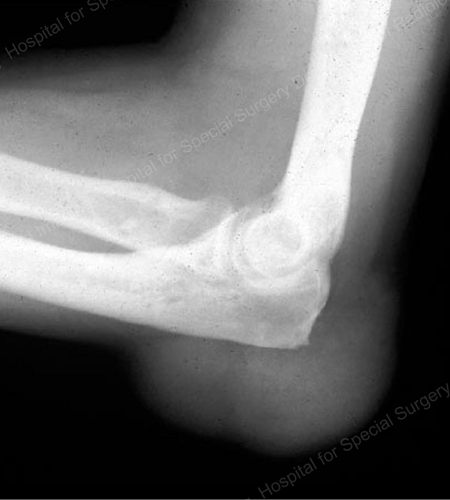
Figure 17: 肘の軟部組織腫瘤として見られる大きなトプス
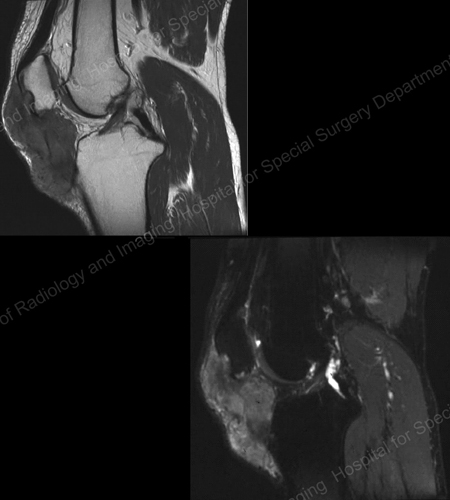
図18
。 MRI of the Knee Showing Gouty Soft Tissue Mass Erosion of the Kneecap
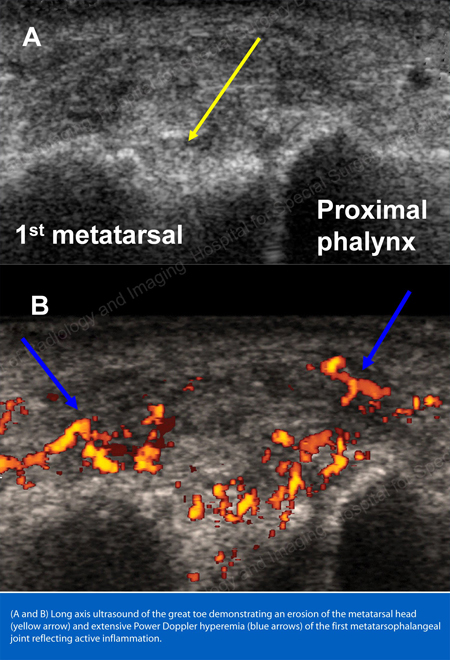
図19:第1趾の付け根に痛風性炎症を示すパワードップラー検査
関節が赤く熱を持ち、関節痛が急速に加速することから、痛風を強く示唆し、トフィ(図7~10参照)が存在すれば、さらに役立ちます。 例えば、ピロリン酸カルシウムという別の結晶によって起こる偽痛風は、痛風と同じように関節が熱くなったり、赤くなったり、痛みが急激に増したりします。 偽痛風は、X線検査で関節内にカルシウムの沈着が見られることで見分けられますが、その沈着の仕方が痛風とは異なります。
結晶による第3の関節炎であるハイドロキシアパタイト沈着症では、結晶の種類を特定するために特別な研究(その1つが電子顕微鏡による研究)が必要なものがあります。
(記事のトップへ)
痛風の発作はどのように治療するのか
痛風の急性発作の治療は、その後の発作の予防とは非常に異なります。
予防に用いるアロプリノール(後述)などの治療薬は、発作時に投与するとかえって悪化することがあるため、数週間、発作が治まるまで我慢する必要があります
痛風の発作を治すための対策はたくさんあります。 急性痛風の治療法については、表2をご覧ください。
痛風の発作が1日以上続いてから治療を開始した場合、治療への反応はかなり遅くなる可能性があります。
表2 痛風の急性発作を治療する薬
- 非ステロイド性抗炎症薬(NSAIDs)またはCOX-2阻害薬
NSAIDsの例です。 ナプロキセン500mg1日2回、インドメタシン25mg1日3回など。 COX-2阻害剤の例:セレコキシブ200mg1日2回。 考えられる副作用 血圧の上昇、足首の腫れ、胃の不調、潰瘍(長期使用では心筋梗塞や脳卒中のリスクが高まる可能性があるが、痛風の使用は一般にごく短期間である)。- 抗炎症性コルチコステロイド
抗炎症性コルチコステロイドの例です。 プレドニゾン40mg初日、30mg2日目、20mg3日目、10mg4日目。 考えられる副作用 血圧の上昇、血糖値の上昇、気分の変化。 痛風のような短期間の使用は、一般に長期間の使用よりもはるかに忍容性が高い。- コルヒチン
以前は痛風発作にコルヒチンの大量投与が行われたが、多くの患者に下痢を引き起こす傾向があった。- コルヒチン
以前は痛風発作に高用量のコルヒチンが使用されていたが、多くの患者に下痢を引き起こす傾向があった。 他に投与量の調節が必要な疾患がないと仮定すると、痛風発作の場合、痛風発作が始まったらできるだけ早くコルヒチンとして1錠0.6mgを2錠投与します。 痛風発作が始まったらできるだけ早くコルヒチン0.6mgを2錠服用し、1時間後にさらに1錠服用します。 腎機能が著しく低下している場合には、コルヒチンの用量を調節する必要がある。 コルヒチンは他の薬、特にクラリスロマイシン(ビアキシン®)と相互作用がある。- ステロイド局所注射
ステロイド注射の例:関節の大きさによって使用量が異なり、また複数の製剤がある。 副作用の可能性あり。 1~2%の確率で、注射に対する局所反応が起こり、翌日には関節が一時的に悪化し、氷で冷やす必要があることがあります。 糖尿病患者の場合、1回の局所注射で一時的に血糖値が上昇することがあります
a)痛風の急性発作の治療における身体的措置。 痛風発作が下肢に起こっている場合は、足から離れることが重要です。 発作を無視しようとすると、より長引くことになる。 局所氷冷法が有効であることが示されています(皮膚損傷を避けるため、1回に10分以内)。
b) 急性痛風の薬物療法:
- 非ステロイド性抗炎症剤とCOX-2阻害剤は、禁忌のない患者においては、痛風の急性発作の主な治療法となっています。 ナプロキセン(ナプロシン®)、イブプロフェン(モトリン®)、セレコキシブ(セレブレックス®)、インドメタシン(インドシン®)など、多くの薬剤が含まれています。 これらの薬剤は、痛風の炎症と痛みを確実に抑えます。 しかし、潰瘍、高血圧、冠動脈疾患、体液貯留のある患者さんは、痛風発作の解消に必要な短期間(通常3~7日間)であっても、これらの薬剤の使用に注意する必要があります。 非ステロイド性抗炎症剤は、完全な抗炎症作用が必要なため、痛風発作の解消に必要な用量は高い方です。 表2の投与量の例を参照してください。 市販の用量、例えばイブプロフェン200mg、1日3回2錠では不十分なことが多い。
- プレドニゾンやメチルプレドニゾロン(Medrol®)などのコルチコステロイドは、痛風発作にかなり有効な抗炎症薬である。 抗炎症剤のステロイドは、男性ホルモンのステロイドとは作用や副作用が大きく異なります。 抗炎症ステロイドは、長期的には骨粗鬆症や感染症などのリスクがありますが、短期間(例えば3~7日間)の治療ではそのリスクは比較的低いとされています。
- コルヒチン(Colcrys®)は痛風発作の予防と治療の両方に役割を果たします(予防における役割については下記を参照)。 痛風発作に対するコルヒチンの詳細については、表2をご参照ください。 コルヒチンの魅力は、その特異性にあります。 例えば、痛風の発作は治りますが、関節リウマチの再燃には効きません。 また、コルヒチンの量が増えすぎると、例えば重度の腎臓病の患者さんに通常量を投与した場合、血液細胞の産生が抑制されるなどの毒性が現れることがあります。 コルヒチンは、かつては経口投与のほかに静脈内投与も行われていました。 静脈内投与は非常に有効で、下痢も起こしませんが、投与を誤ると骨髄の血球の産生を停止させ、命にかかわる可能性があるため、極めて慎重に投与する必要がある薬剤です。 そのため、コルヒチンの静脈内投与は現在では非常に稀です。 患者さんからは、長年ノーブランドで販売されてきたコルヒチンが、なぜブランド薬(コルクリス®)になったのかという質問をよく受けます。 これは、昔からある薬で、これまでFDAの審査を受けていなかったものを見直し、製造を標準化しようとした結果です。 コルヒチンは、新しい研究(薬物相互作用や投与量の再評価など)が行われ、非ブランド薬が長い間入手可能であったにもかかわらず、FDAがメーカーにブランド権を与えた少数の薬剤の1つです
- 副腎皮質ホルモンの結晶調剤の局所注射は、患者が単一関節痛風の発作を起こした場合に優れた選択肢となりえます。 注射する製剤には、酢酸メチルプレドニゾロン(デポメドロール®)、トリアムシノロン(アリスパン®)、ベタメタゾン(セレストーン®)があります。 これらの製剤の中では、ベタメタゾンの関節内持続時間が最も短いのですが、いずれにしても痛風は数週間で自己限定する傾向がありますので、この選択肢はかなり有効です。 ベタメタゾンの利点は、ステロイド局所注射の最も一般的な副作用である、注射の翌日に一時的に悪化する可能性が低いことです。 局所注射はまた、関節に感染を引き起こすという非常に小さなリスクを伴いますが、痛風がまだ確定診断されていない場合、同じ針で液体を採取して、尿酸結晶の存在を分析できるという利点があります。 痛風発作は食べ物によって直接引き起こされることがあるので、痛風の患者さんは、どの食べ物が発作を引き起こしやすいかについてカウンセリングを受ける必要があることは明らかです。 例えば7.0mg/dLといった軽度の尿酸値上昇の患者さんでは、食事管理で十分かもしれません(痛風の患者さんにとっては、たとえ検査機関が「正常範囲」と呼ぶ値であっても、6.0以上の尿酸値はすべて上昇と見なされることに注意してください)
例えば10.0mg/dLといった高い値の患者さんでは、食事管理で十分かもしれません(検査機関が「正常範囲」と呼ぶ値は、6.0以上の尿酸値はすべて上昇と見なされます)
そして、痛風の患者さんは、食事管理で十分かもしれません。0mg/dLでは、食事療法だけでは痛風を予防できないことがほとんどです。 後者の場合、非常に厳しい食事制限をしても血中尿酸は1mg/dL程度しか減少せず、一般に尿酸が関節に析出するのを防ぐには十分ではありません。 4
以上のように、痛風患者における食事への配慮は有用であり、特に尿酸を下げる薬物治療を始めたばかりの頃は、逆説的に痛風発作を誘発する可能性があるため、注意が必要です。 赤身の肉や貝類(ホタテ、エビ、ムール貝など)は、理想的には食べる頻度を減らし、量を少なく(例えば、3オンス)することです。 すべての種類のアルコールは、腎臓で再吸収される尿酸を増やし、血中尿酸値を上昇させますが、ビールはそれ自体プリン体量が多いため、2種類の方法で血中尿酸値上昇に寄与しています。 植物性タンパク質は分解されてプリン体になりますが、痛風の大きな要因とはならないようです。 オートミール、小麦胚芽、ふすまなどの炭水化物には中程度のプリン体が含まれていますが、痛風の重大な危険因子であることは示されていません。 食事による尿酸の最大限の低下に関心のある方には、以下の「痛風に関する書籍」のセクションに2冊の「Gout Haters Cookbooks」が掲載されており、その4冊の料理本すべてがオンラインで購入できます。
b) 痛風の予防における身体活動の役割 7 痛風が確立している患者さん、特にX線検査で足の関節の損傷が確認されている場合は、負荷の少ない運動プログラムを実施することが妥当です。 7 下肢に発作が起きそうな場合は、衝撃が痛風発作を悪化させるようなので、患者さんは足から離れるようにするのがよいでしょう。 痛風発作の兆候としては、特に足、足首、膝などの関節の腫脹、熱感、発赤、圧痛などが挙げられます。
c)痛風の予防における薬物の役割。 (痛風発作を予防するための薬の概要については表3をご覧ください。)
表3 痛風の発作を予防する薬
- アロプリノールとフェブキソスタット:尿酸の生成を抑える
- Probenecid と lesinurad.。 尿酸の排泄を増やす
- ペグロチターゼ:尿酸の分解を増やす
- コルヒチン:尿酸結晶が炎症を引き起こす能力を低下させる。
1. 痛風発作の予防における標準的な薬物:
i. コルヒチン(Colcrys®):前述の「マッチ」の例えを用いると1、コルヒチンの使用は、尿酸の「マッチ」を「弱める」ことと見なすことができます。 コルヒチンは体内に蓄積された尿酸を下げるのではなく、尿酸の結晶に対する体の炎症反応の強さを低下させるのです。 最近の研究では、コルヒチンの作用機序の少なくとも1つは、痛風の炎症に重要な炎症性タンパク質(サイトカイン)であるインターロイキン1-βの産生につながる反応のカスケードを防ぐ作用によることが示されています8
1日に1~2錠(各0.6mg)使用すると、ほとんどの人がこの薬によく耐え、この量は痛風の発作を防ぐのに有効です。 コルヒチンは、痛風発作が1回ひどくても2回中程度でも開始し、それ以降はアロプリノールを使用する医師もいます。 同じ12ヶ月の間に2回痛風発作を起こした場合は、一般にコルヒチンでは達成できない尿酸を下げる薬で治療することが勧められます。 尿酸降下薬であるアロプリノールとプロベネシドについては、以下をご参照ください。 コルヒチンの長期服用で神経や筋肉への影響がまれにあり、コルヒチンを常用している患者さんでは約半年間隔で筋肉からの血液検査(CPK)を行い、経過を観察しています。 また、コルヒチンは、アロプリノール(後述)の治療を始めるときに、痛風発作が増加するのを防ぐという大きな役割も持っています。 その場合、痛風発作が起こらなければ、コルヒチンは6ヶ月程度で中止することが多いようです
ii. アロプリノール アロプリノール:現在、痛風の予防薬として最もよく使用されている薬剤です。 アロプリノールはキサンチンオキシダーゼという酵素を阻害し、プリン体の分解を阻害して、体内の尿酸の総量を減少させる。 アロプリノールは、尿酸が上昇したメカニズムが何であれ、痛風の予防に有効です。 尿酸を作りすぎている人も、腎臓から排泄されにくい人も、アロプリノールの尿酸生成量の減少によって、体内の総尿酸量が減少するという同じ目標につながります。 アロプリノールの最も一般的な副作用は、治療初期に痛風発作が増加することです。 このため、最初はコルヒチン(上記参照)と一緒に開始することが多く、「マッチ」1がゆっくりと取り除かれる一方で、残ったものは「弱められる」ことになります。 アロプリノールの他の副作用には、皮膚の発疹、肝臓の血液検査の異常、時には白血球数の減少が含まれます。 アンピシリンという抗生物質は、すでにアロプリノールを服用している患者さんに、より多くの発疹を引き起こすようです。 まれにですが、非常に重篤な副作用として、アロプリノール過敏症症候群があり、重篤な肝臓や血球の異常とともに、重篤な発疹を呈することがあります。 この点については大きな議論がありますが10、一般的には、腎機能異常のある患者さんはアロプリノールを低用量から開始し、アロプリノールが効率よく排泄されるように増量することが望ましいとされています。 これらの患者さんの尿酸値をよく観察し、尿酸値を目安にアロプリノールの投与量を徐々に増やしていきます。 アロプリノール過敏症症候群の重症度は、どの患者にアロプリノールを投与すべきか、特定の基準を用いて決定しなければならないことを思い知らされます(表4:尿酸を下げる薬を使う理由参照)。
Table 4: 尿酸値を下げる薬を使う理由
- 尿酸の過剰産生や排泄の困難さによるものであれ、年に2回以上の発作がある痛風
- 慢性的に目に見える尿酸の集まり(トフィ)
- 尿中の高い尿酸(24時間で800mg以上)、特に腎臓結石の経験があれば
- 痛風の関節症を抑えるための他のオプションで失敗(例えば、、、)。 プロベネシドの失敗)
- 白血病やリンパ腫の化学療法を受けていて、多くの腫瘍細胞が殺されると予想される場合(細胞の分解産物の1つがプリンで、それが分解されて尿酸になるから)
iii.白血病の化学療法を受けている場合。 フェブキソスタット(Uloric®):この薬は、尿酸値を下げることにより痛風患者を治療する目的で、2009年2月にFDAにより承認されました。
アロプリノールと同様に、フェブキソスタットの最も一般的な副作用は、本剤の投与開始後に痛風が再燃することです。 アロプリノールと同様に、フェブキソスタット開始後少なくとも6ヶ月間はコルヒチンなどの予防薬を追加し、痛風の再燃を防ぐことが可能な限り合理的である。
フェブキソスタットの利点として、アロプリノールとは構造的に全く異なるため、アロプリノールにアレルギーがある患者にも使用できる可能性が高いことが挙げられます。 これまで、アロプリノールにアレルギーのある限られた患者さんしか調査していませんが、そのような患者さんでも本薬剤は耐性が認められました。
ワルファリン(クマジン®)と相互作用を示すアロプリノールと異なり、フェブキソスタットにはこの相互作用は認められませんでした。 フェブキソスタットは1日40mgから開始し、2週間投与しても尿酸値が目標値(6.0mg/dL未満)に達しない場合は、1日80mgに増量することがFDAにより承認されています。 フェブキソスタット80mgの投与により、最も一般的に使用されているアロプリノール300mgの投与よりも多くの患者さんが尿酸値6mg/dL未満に到達しました。 アロプリノールの高用量に関する文献は限られていますが、リウマチ専門医は尿酸値目標を達成するために必要であれば、300mgより高用量のアロプリノールを調整することがよくあります。
尿酸値がコントロールされ、アロプリノールでうまくいっている患者さんは、アロプリノールの低コストと40年間の全体的に非常に良い安全性記録(上記の「アロプリノール」の議論を参照)から見て、この新しい薬剤に切り替える理由はないように思えます。
2018年の3月に、アロプリノール対フェブキソスタットの心臓安全性に関する研究が発表されています。 この研究では、5000人の患者さんを対象に、心臓発作、脳卒中、min-stroke、冠動脈疾患による緊急心臓手術の必要性のいずれかの心血管疾患歴がある方ばかりを対象に調査を行いました。 この研究では、心血管系の転帰の組み合わせ(心臓発作、脳卒中、心臓死、ミニストローク、冠動脈疾患による緊急心臓手術)が、アロプリノール群とフェブキソスタット群のどちらに多いかを検討した。 これらのアウトカムの組み合わせについては、2つの薬剤は同じであった。 しかし、心臓死はフェブキソスタット群の方が多かった。 死亡した患者のほとんどが、アロプリノールであれフェブキソスタットであれ、痛風の薬をすでに中止していたため、この研究の解釈にはいくつかの問題があった。 また、5年間の研究では脱落率も高かった。 多くのリウマチ専門医は、これが決定的な研究ではないと考えており、フェブキソスタットによる心臓リスクの上昇を示さない他のデータもあるのです。
FDAがフェブキソスタットにこの警告を出した以上、腎臓に異常がある人でもアロプリノールを先に開始する可能性が高いでしょう。 フェブキソスタットをすでに服用していて、アロプリノールを服用したことがない人の場合、アロプリノールに切り替えるかどうかは、個々のケースで判断することになります。 フェブキソスタットに耐性があり、アロプリノールに耐性がない可能性もあるので、難しい判断になります。 アロプリノールは腎機能異常のある人では重症皮膚反応のリスクが高く、この異常のある人はフェブキソスタットを使用していることが多い。 これらのデータを考慮した結果、このような状況にある多くの患者さんはフェブキソスタットを使い続けることを選択していますが、この判断は各人が、担当医とともに行います。
iv. プロベネシド。 この薬は、腎臓で再吸収される量を減らすことによって、尿中に排泄される尿酸の量を増やします。 尿酸をより多く尿中に出すことができる薬は、尿酸降下薬と呼ばれます。
アロプリノールと同様に、プロベネシドを開始すると痛風発作の回数が増えることがあるため、治療開始後6カ月間はコルヒチンを投与することが多くなります。 しかし、アロプリノールと異なり、治療初期にプロベネシドは尿酸を増加させ、腎臓結石の発生につながる可能性があります。 このため、プロベネシド投与開始前に24時間尿を採取して尿酸を調べ、この結果が>800mg/24 時間であれば、この治療を再検討するのが妥当であろう。 もし結果がボーダーラインであれば、治療の初期に腎臓結石を予防するために、最低限水分を多めに摂るように勧めます。 また、尿の酸性度を変える薬もあり、その場合は尿をアルカリ化することで腎臓結石のリスクを減らすことができます(尿酸はアルカリ性の媒体に溶けやすく、結晶化しにくくなります)。 プロベネシドも発疹を起こすことがありますが、アロプリノールに比べると、非常に重い過敏性反応を起こす可能性は低いと思われます。 プロベネシドは、腎機能障害のある患者には有効ではありません。
12 Sundy JS et al: Reduction of Plasma Urate Levels Following Treatment With Multiple Doses of Pegloticase (Polyethylene Glycol-Conjugated Uricase) in Patients With Treatment-Failure Gout (痛風の治療失敗例における、ペグロチターゼの複数回投与による血漿尿酸レベルの低下): 無作為化第II相試験の結果。 Arthritis Rheum 58:9, 2882-2891, 2008.
13 Sundy JSら:Efficacy and Safety of Intravenous Pegloticase (PGL) in Treatment failure gout (TFG).PGL は、治療失敗痛風患者を対象とした有効性と安全性の研究です。 Gout-1およびGout-2からの結果。 European League Against Rheumatism Abstract THU0446、2009年6月。 欧州リウマチ学会2009年大会要旨
14 Baraf, HSB et al: Reduction of tophus size with pegloticase (PGL) in treatment failure gout (TFG): Gout-1とGout-2の結果、European League Against Rheumatism Abstract OP-0047, June 2009. European League Against Rheumatism Meeting 2009より抜粋
15 So A et al: A pilot study of IL-1 inhibition by anakinra in acute gout. Arthritis Research & Therapy 9(2):R28, 2007.
16 Terkeltaub Rら:The interleukin 1 inhibitor rilonacept in treatment of chronic gouty arthritis: Results of a placebo-controlled, monosequence crossover, non-randomised, single-blind pilot study.痛風の発作にアナキンラが有効であるという初期のデータです。 また、このような患者さんには、「痛風の治療と再発予防のためのカナキヌマブ(ACZ885)対トリアムシノロンアセトニド」をお勧めします。 アメリカン・カレッジ・オブ・リウマチ アブストラクト LB4, October 2009. アメリカン・カレッジ・オブ・リウマチ・ミーティングの抄録(2009年10月)
18 Fitz-patrick D et al: Abstract 150: Effects of a Purine Nucleoside Phosphorylase Inhibitor, BCX4208, on the Serum Uric Acid Concentrations in Patients with Gout. Abstract from the American College of Rheumatology Meeting November 2010.
(Go back to top of article)
Updated: 12/18/2017
Authors
 Theodore R. Fields, MD, FACP
Theodore R. Fields, MD, FACP
Attending Physician, Hospital for Special Surgery
Professor of Clinical Medicine, Weill Cornell Medical CollegeRelated Patient Articles