脂肪細胞
脂肪細胞は体内の主要なエネルギー貯蔵部位であり、また重要な内分泌機能も持っています。 したがって、脂肪細胞の発生と機能を理解することは、特に肥満のパンデミックに照らして、代謝のホメオスタシスを理解する上で不可欠である。 脂肪細胞には、1つの大きな脂質滴としてエネルギーを貯蔵し、重要な内分泌機能を有する白色脂肪細胞と、複数の小さな脂質滴としてエネルギーを貯蔵し、特に体温を生成する(熱発生)ための燃料として用いられる褐色脂肪細胞の2種類が存在します。 褐色脂肪細胞は、ミトコンドリア局在型脱共役タンパク質1(Ucp1)を特異的に発現することにより、熱産生を可能にしている。 しかし、白色脂肪細胞の中には温度や食事によって褐色脂肪細胞の特徴を持つもの(ブライトまたはベージュ脂肪細胞と呼ばれる)があり、またその逆もあるので、これらの分類は単純化されすぎている。 私たちは、さまざまな脂肪細胞の起源を理解し、その発生、分布、機能を制御するシグナル伝達および代謝経路を定義することに関心があります。
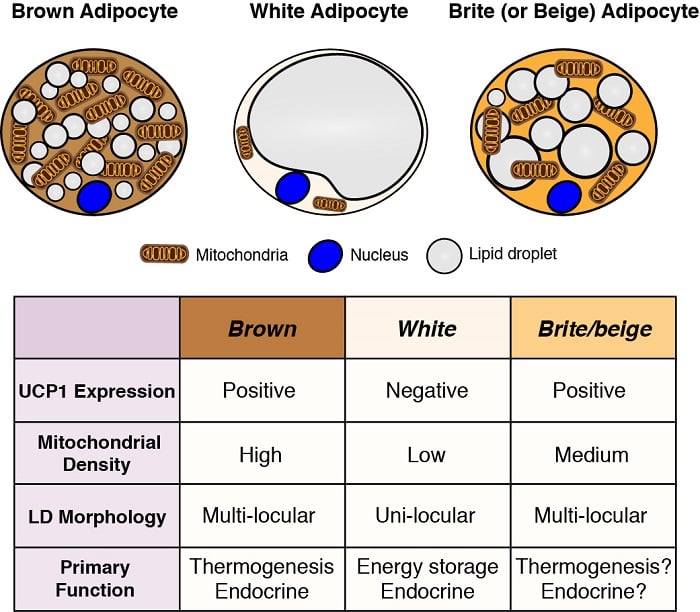
脂肪細胞の起源
健康や病気における脂肪組織の役割を理解するための中心は、それがどのように成長するのかを理解することです。この点、脂肪組織生物学の分野で最も理解が遅れているものの一つは、異なる種類の脂肪細胞の発生的な起源です。 脂肪細胞の起源を明らかにすることは、特に肥満や脂肪異栄養症の人の体脂肪分布パターンを説明するのに役立ち、また、いくつかの脂肪層で観察される代謝の違いを説明する手がかりになるかもしれない。 また、脂肪細胞の前駆細胞やその増殖を制御するメカニズムを明らかにすることは、健康な脂肪組織の機能を理解し、管理する上で極めて重要である。 また、前駆細胞から「健康な」脂肪細胞(褐色脂肪細胞やブライト/ベージュ脂肪細胞など)を発生させ、脂肪と戦うことを本質とした細胞ベースの治療法を開発することも可能かもしれない。 我々は以前、遺伝学と系統追跡法を組み合わせて、異なる脂肪層に存在する脂肪細胞の起源をマッピングした。 その結果、脂肪細胞は複数の発生起源を持ち、脂肪細胞の運命は外来因子と内在因子の両方に依存する可能性が高いというモデルを支持する、予想外のレベルの異質性が明らかになった。
脂肪細胞は複数の発生起源を持つ
(左下)マウスにおける脂肪組織の解剖学的分布。 褐色脂肪組織(BAT)と白色脂肪組織(WAT)を示している。 (右下)発生前駆細胞およびその子孫細胞すべてに、Myf5(パネルa)またはPax3(パネルb)の発現に関連した蛍光標識で消えないようにした系譜追跡実験の一例。 緑色(mGFP)で標識された脂肪細胞は、赤色(mTFP)で標識された脂肪細胞とは異なる前駆細胞から発生したものである。
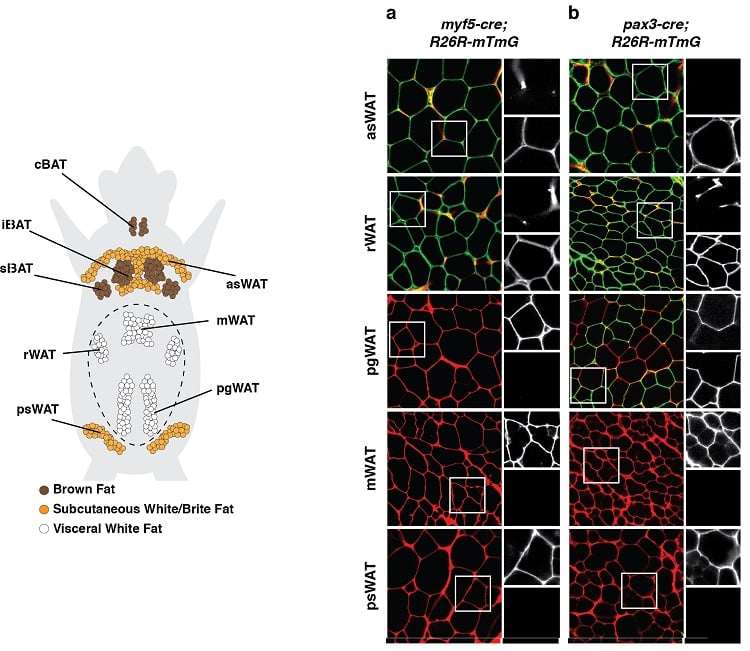
このような結果は、脂肪細胞が複数の発生起源を持つことを示唆しています。
(Sanchez-Gurmaches& Guertin, Nature Communications 2014; Sanchez-Gurmaches et al., Trends in Cell Biology 2016から引用)
褐色脂肪細胞
褐色脂肪細胞は魅力的な細胞です。 哺乳類にのみ存在し、その主な機能は、熱発生と呼ばれるプロセスで内因性の熱を生成することです。 これは、アンカップリングプロテイン1(UCP1)と呼ばれるミトコンドリア膜タンパク質がユニークに発現していることによって可能となります。 このような褐色脂肪のエネルギー消費特性や、近年、成人したヒトにも褐色脂肪があることが明らかになり、栄養過多を解消するための治療法のターゲットとして注目されている。 また、活動的な褐色脂肪細胞は、多様な栄養素(グルコース、脂質、アミノ酸など)を同時に大量に取り込んで消費し、同化代謝と異化代謝を同時に行うことができるなど、最も興味深い代謝プログラムの1つである。 例えば、私たちは以前、寒冷刺激を受けたBATが、脂肪酸酸化経路に加え、デノボ脂質合成経路をサポートする遺伝子プログラムを広くアップレギュレートしていることを明らかにしました 。 私たちは、この驚くべき逆説的な代謝についてもっと理解したいと思っています。
褐色脂肪組織の発達と代謝についてもっと知る
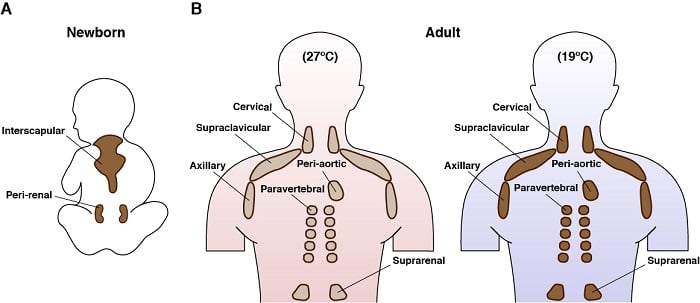
ヒトにおける褐色脂肪の解剖学的位置
また私たちは遺伝子モデルを使って、シグナル伝達経路がBAT代謝をいかに制御するかを調査しています。 例えば、マウスを使って、褐色脂肪組織でのみmTORC2のユニークで必須の構成要素をコードするRictorを遺伝的に欠失させました。 mTORC2について詳しくはこちら 驚くべきことに、これらのマウスは高脂肪食から保護されている。 より具体的には、BAT Rictor欠損マウスは、高脂肪食を食べても肝臓や内臓脂肪組織に過剰な脂質を蓄積しませんでした。 これらの部位に過剰な脂質が蓄積することは、危険なほど不健康であるため、これは非常に興味深い発見です。 私たちは、遺伝学、ゲノミクス、メタボロミクス、生化学を組み合わせて、これらのマウスが高脂肪食から保護される理由を解明しようとしています。
白色脂肪細胞
白色脂肪細胞は、ヒトの脂肪細胞の中で最も多く存在するものです。 白色脂肪組織デポはまた、エネルギーを膨張させて貯蔵する顕著な能力を持っており、脳や他の組織に信号を送って摂食行動や代謝のホメオスタシスに強い影響を与える。 しかし、白色脂肪細胞は過剰な栄養素を安全に閉じ込めるよう特別に適応している一方で、その有益な機能が破綻するティッピングポイント(肥満時など)があり、これが代謝性疾患や2型糖尿病の発症を強く促しているのである。 何がティッピングポイントを定義するのだろうか? 白色脂肪細胞はどのように他の組織へシグナルを送るのか? 白色脂肪細胞はどのように他の組織にシグナルを送るのか? なぜ内臓脂肪が過剰になると、皮下脂肪が過剰になるよりも健康に害を及ぼすのか? これらはすべて、私たちが興味を抱いている未解決の問題です。
私たちは、白色脂肪細胞におけるmTORシグナルについても研究しています。mTORは、脂肪細胞が反応する主要なホルモンであるインスリンシグナルの下流の主要な標的となっています。 遺伝学的なマウスモデルを用いて、すべての脂肪細胞においてmTORC1またはmTORC2のいずれかを選択的に阻害しました。 白色脂肪組織でmTORC1を阻害すると、インスリン抵抗性と脂肪肝疾患を伴うリポディストロフィー様症候群が引き起こされる。 白色脂肪組織のmTORC2を阻害しても、脂肪組織量の変化とは無関係に、インスリン抵抗性が引き起こされる。 後者のモデルでは、mTORC2が脂肪細胞由来のシグナルを制御し、肝臓と交信して肝グルコース産生を制御しているようである。
白色脂肪細胞におけるmTORC2シグナル伝達モデル
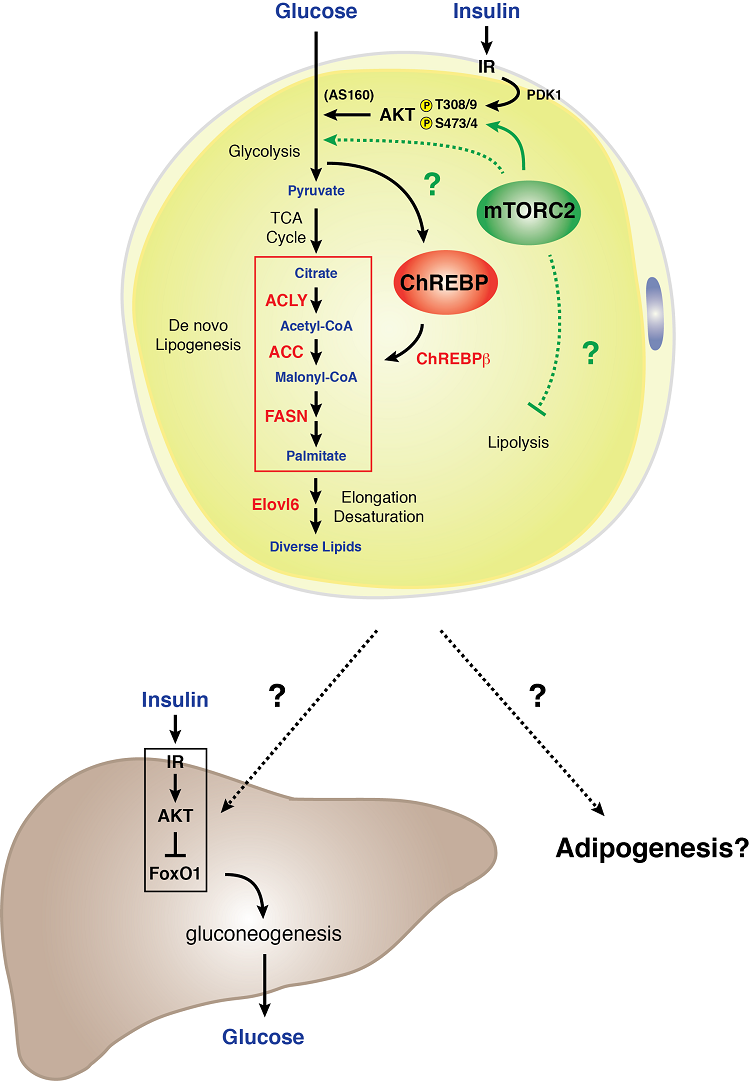 白色脂肪細胞は通常の糖質および脂質代謝にmTORC2を必要とします。 我々は、白色脂肪細胞に特異的にRictor(mTORC2)を遺伝的に欠損させると、グルコースの取り込みが減少し、ChREBP-β転写因子とその下流標的(デノボ脂肪生成経路で機能する酵素を含む)の発現が減弱することを発見した。 さらに、白色脂肪細胞におけるmTORC2の欠損は、重度の肝インシュリン抵抗性をもたらす。 これらのデータは、白色脂肪細胞のmTORC2が糖質および脂質代謝の必須調節因子であり、全身のグルコースホメオスタシスを制御する肝外栄養感知器官コミュニケーション機構の重要な構成要素であることを示す 。 白色脂肪におけるmTORC2シグナルの生物学を理解することは、白色脂肪組織がどのようにグルコース感知器官として、また全身の代謝体力の媒介者として機能するかを知る重要な手がかりとなるであろう。
白色脂肪細胞は通常の糖質および脂質代謝にmTORC2を必要とします。 我々は、白色脂肪細胞に特異的にRictor(mTORC2)を遺伝的に欠損させると、グルコースの取り込みが減少し、ChREBP-β転写因子とその下流標的(デノボ脂肪生成経路で機能する酵素を含む)の発現が減弱することを発見した。 さらに、白色脂肪細胞におけるmTORC2の欠損は、重度の肝インシュリン抵抗性をもたらす。 これらのデータは、白色脂肪細胞のmTORC2が糖質および脂質代謝の必須調節因子であり、全身のグルコースホメオスタシスを制御する肝外栄養感知器官コミュニケーション機構の重要な構成要素であることを示す 。 白色脂肪におけるmTORC2シグナルの生物学を理解することは、白色脂肪組織がどのようにグルコース感知器官として、また全身の代謝体力の媒介者として機能するかを知る重要な手がかりとなるであろう。