酸素ファミリー
酸素族は、周期表の16族を構成する元素、酸素、硫黄、セレン、テルル、ポロニウムから構成されています。 これらの元素はすべて、最も外側のエネルギー準位に 6 個の電子を持っているため、化学的性質が共通しています。 しかし、別の見方をすれば、これらの元素は互いにまったく異なっている。 酸素は気体の非金属、硫黄とセレンは固体の非金属、テルルは固体の金属、そしてポロニウムは固体の金属である。
知っておきたい言葉
酸。 水に溶かすと塩基と反応して塩を形成し、水素イオンを放出することができる物質。
アロートロープ(Allotrope)。 ある元素の2つ以上の形のうちの1つ。
燃焼。
燃焼:酸化の一形態で、顕著な熱と光が発生するほど急速に起こること。
クラッキング(Cracking)。 大きな炭化水素分子がより小さな構成要素に分解されるプロセス。
電解:電気分解。 電流が化学変化を引き起こすプロセスで、通常は何らかの物質が分解される。
同位体。 原子核内の陽子の数は同じだが中性子の数が異なる、同じ元素の2つ以上の形態。
岩石圏。 地球の固体部分、特に外側の地殻の領域。
LOX:液体酸素の略称。
冶金学。
冶金:金属を鉱石から得て、実用的な価値を持つ形に変換する科学技術。
新生酸素。
新生酸素:酸素の同素体で、分子内に酸素原子を1個含むもの。
オゾン。 1分子あたり3個の原子からなる酸素の同素体。
プロデューサーガス。 一酸化炭素と水素を主成分とする合成燃料。
タンパク質。
タンパク質:すべての生体細胞の構造と機能に不可欠な大きな分子。
放射性崩壊。 放射性元素の原子の集団が時間の経過とともに自然に崩壊する予測可能な方法。
酸素
酸素は無色、無臭、無味の気体で、融点は -218°C (-360°F) であり、沸点は -183°C (-297°F) です。 地殻中に最も多く存在する元素で、重量にして大気の約4分の1、岩石圏(地殻)の約2分の1、水圏(海、湖、その他の水)の約85パーセントを占めている。 遊離元素として、また多種多様な化合物の中に存在する。 大気中では元素状酸素として存在し、2原子分子であるO 2から構成されているため、二酸素と呼ばれることもある。 また、岩石圏では、酸化物、炭酸塩、硫酸塩、ケイ酸塩、リン酸塩、硝酸塩などの化合物として存在する。
酸素は、1 分子あたり 1 つの原子 (O) と 1 分子あたり 3 つの原子 (O 3 ) という 2 つの同素体 (同じ物質で物理的または化学的に異なる形態) でも存在します。 前者は単原子酸素、後者は三原子酸素、またはオゾンとして知られています。 自然界では、ほとんどの場合、2原子型の酸素が優勢である。 しかし、成層圏の上層部では、太陽エネルギーによって2原子型が1原子型に分解され、2原子分子と再結合してオゾンが形成されることがある。 オゾンは、地表の動植物にとって有害な紫外線を吸収する性質があるため、地球の大気中にオゾンが存在することは、生命の存続に不可欠なのである。
酸素は、スウェーデンの化学者カール・シャイー(1742-1786)とイギリスの化学者ジョセフ・プリーストリー(1733-1804)によって、1773年から1774年にかけて別々に発見されました。 1770年代後半にフランスの化学者アントワーヌ・ローラン・ラヴォアジエ(1743-1794)によって元素名が付けられた。 その名前は、すべての酸が酸素を含んでいるというラヴワジエの誤った考えを反映し、フランス語の「酸生成剤」に由来している。
製造方法。 酸素を商業的に生産する最も一般的な方法は、液体の空気を分留する方法である。 空気のサンプルをまず-200℃(-330°F)の範囲の非常に低い温度まで冷やす。 この温度では、空気を構成するほとんどの気体が液体になる。 そして、この液体の空気を蒸発させる。 約-196℃の温度で窒素が沸騰し始める。 窒素がほとんどなくなると、アルゴンやネオンも沸騰し、不純物の多い酸素が残る。 酸素が不純物なのは、液体中にクリプトンやキセノンなどのガスがわずかに残っているためである。 さらに酸素を純化するために、冷却、液化、蒸発の工程を繰り返すこともある。
酸素は通常、液体のまま貯蔵、輸送されます。 LOX容器は、壁の間を真空にした二重壁容器からなる、非常に大きな真空ボトルのようなものです。 また、高さ1.2メートル、直径23センチの鋼鉄製の容器に気体として貯蔵し、輸送することも可能で、輸送の負担が少ない。 多くの場合、酸素は使用される場所で製造される。 前述した分留工程は非常にシンプルかつ安価であるため、多くの産業で酸素製造設備を自前で用意することが可能である。
用途。 酸素は商業用、工業用など多くの用途があり、米国での生産量では常に上位5位以内にランクされている。 たとえば、1990年には、約180億キログラム(390億ポンド)の酸素が米国で製造されました。
酸素の用途は、冶金、ロケット、化学合成、医学の4つに大別されます。 例えば、高炉で鉄鉱石を処理する際、酸素を使ってコークス(炭素)を一酸化炭素に変える。 一酸化炭素は、酸化鉄を還元して純粋な金属鉄にする。 次に酸素は、鉄の加工の第二段階として、ベッセマー転炉、平炉、または基礎酸素法という方法で「銑鉄」を「鋼鉄」に変える際に使用されます。 この工程では、酸素は銑鉄に含まれる余分な炭素、シリコン、金属と反応し、鉄を製造するために除去されなければならないのである。
酸素のもう一つの冶金的用途は、溶接や切断に使われるトーチです。 酸素と水素の反応(オキシ水素トーチ)、または酸素とアセチレンの反応(オキシアセチレントーチ)を利用した2種類のトーチが最も一般的である。 いずれも3,000℃以上の高温になるため、ほとんどの金属材料の切断や溶接に使用できる。
酸素はLOXという形で、ロケットやミサイルの酸化剤として広く使われている。 たとえば、スペースシャトルを宇宙へ運ぶための巨大な外部燃料タンクには、55万リットル(14万5000ガロン)の液体酸素と150万リットル(39万ガロン)の液体水素が貯蔵されています。 この2つの元素がシャトルのメインエンジンで反応すると、最大512,000ポンドの推力を発揮する。
化学業界では、さまざまな化学合成(生成)反応において、毎年膨大な量の酸素を使用しています。 その中でも最も重要なのが、酸素による炭化水素の分解です。 ほとんどの場合、炭化水素を酸素で加熱すると燃焼が起こり、二酸化炭素と水が主な生成物となる。 しかし、炭化水素の混合物に酸素を供給する速度を注意深く制御すると、炭化水素は「分解」され、アセチレン、エチレン、プロピレンなどの他の生成物を生み出す。
また、酸素を主要な反応物質の1つとして、さまざまな種類の合成燃料を製造することができる。 例えば、高温の石炭やコークスの床に、制御された速度で酸素を通過させることによって、プロデューサー・ガスが製造される。 この反応で発生する二酸化炭素の大部分は一酸化炭素に還元され、最終製品(プロデューサーガス)は主に一酸化炭素と水素で構成される。
おそらく酸素の最もよく知られた医療用途は酸素療法で、呼吸困難のある患者に純酸素または純に近い酸素を投与します。 酸素療法は、外科手術中、出産時、心臓発作からの回復時、感染症治療時などによく用いられます。 いずれの場合も、純酸素を投与することで心肺への負担を軽減し、回復を早めることができます。
呼吸が困難な環境では、純酸素または酸素を含んだ空気を供給することもできます。 高高度を飛行する航空機はもちろん、船舶の通常の空気供給に問題が生じた場合に備えて、常に酸素を供給しています。 また、深海に潜るダイバーは、酸素を豊富に含んだ空気を携帯するか、ポンプで供給している。
浄水場や下水処理場でも酸素を使用しているところがあります。 自然界に存在する細菌が有機廃棄物を分解する速度を上げるために、水中にガスを送り込みます。 同様の方法で、湖や池の富栄養化率を下げたり、場合によっては富栄養化率を逆転させることができることが分かっています。 (富栄養化とは、水中の栄養塩が溶け出すこと。 水生植物の成長と溶存酸素の減少が、このプロセスの2大結果である)。
最後に、酸素は地球上のすべての動物にとって不可欠なものです。 人は水や食料がなくても数日から数週間は生き延びることができますが、酸素がなければ数分も生き延びることはできません。 酸素がなければ、細胞内で起こっているエネルギー生成の化学反応も止まり、人は死んでしまう。
硫黄
硫黄は非金属元素で、多くの同素体 (同じ物質の物理的または化学的に異なる形態) で存在することができます。 最もよく知られているのは、菱形硫黄と単斜晶硫黄と呼ばれるものです。 どちらも明るい黄色の固体で、融点は約115°C(239°F)です。 第三の形態は塑性硫黄または非晶質硫黄と呼ばれるものです。 菱形硫黄や単斜晶硫黄を溶かすと茶色っぽい液体になります。
硫黄自体には全く臭いがない。 しかし、硫黄の代表的な化合物の中には強いにおいを持つものがあるため、この点では評判が悪い。 二酸化硫黄はその一つで、吸った人に鋭い刺激を与え、窒息させる作用がある。 聖書の「火と硫黄」は、作者が想像しうる最悪の罰の一つである。 この表現にある硫黄は、燃える硫黄、つまり二酸化硫黄のことである。 硫黄は地中深くから発生し、火山の噴煙から二酸化硫黄の臭いがすることから、人々は地獄がどのようなものであるか想像を膨らませたのである。
悪臭を放つ第二の硫黄化合物は硫化水素である。 卵の腐ったような強烈な臭いは、この化合物の存在によるものである。
発生と準備。 硫黄は地殻中に16番目に多く存在する元素である。 元素としても、さまざまな化合物としても存在する。 元素として、それは非常に大規模な、地下鉱山で見つけることができ、最も一般的には、米国の湾岸に沿って、ポーランドとシチリア島で見つけることができます。 これらの鉱山から硫黄を抽出する方法は、フラシュ法である。 この方法では、3本のパイプのうち一番外側のパイプに過熱蒸気を送り込みます。 一番外側のパイプには圧縮空気が送り込まれ、一番内側のパイプには圧縮空気が送り込まれる。 すると、過熱された蒸気が地下の硫黄を溶かし、圧縮された空気が3本のパイプの真ん中を通って地表に押し上げられる。
硫黄は、鉱物や鉱石の形でも広く分布しています。 石膏(硫酸カルシウム、CaSO 4 )、バライト(硫酸バリウム、BaSO 4 )、エプソム塩(硫酸マグネシウム、MgSO 4 )など、その多くは硫酸塩の形で存在する。 その他、黄鉄鉱(硫化鉄、FeS 2 )、ガレナ(硫化鉛、PbS)、辰砂(硫化水銀、HgS)、スティブナイト(硫化アンチモン、Sb 2 S 3 )、亜鉛閃石(硫化亜鉛、ZnS)等、金属硫化物が含まれる。 これらの金属鉱石を空気中で強く加熱すると、硫黄は二酸化硫黄に変化し、純金属が放出されるので、これを回収する。 二酸化硫黄はそのまま硫酸の製造に使われ、世界で採掘される硫黄の90%以上はこの硫酸の製造に使われている。
硫黄とその化合物の用途。 硫黄の一部は殺菌剤や殺虫剤、マッチや花火、火薬、天然ゴムの加硫(ゴムに弾力性や強度を持たせる処理)などに直接使われています。 しかし、そのほとんどは、多くの有用な化合物に変換されている。
硫黄化合物の中で最も重要なのは硫酸である。 生産される硫黄の90%近くは、まず二酸化硫黄に変換され、次に硫酸に変換される。 この硫酸は、米国で生産される化学物質の中で常に第1位を占めている。 1990年には400億キログラム(890億ポンド)以上の硫酸が製造され、2番目に多い化学物質(窒素ガス)の50%以上の量を占めている。 硫酸は、肥料、自動車用バッテリー、石油製品、顔料、鉄鋼、その他多くの製品の製造に使用されている。
硫黄の循環。 窒素、炭素、リンと同じように、硫黄も気体、液体、固体を通過し、硫黄循環と呼ばれる一連の連続的な反応を繰り返しています。 硫黄循環の主なステップを下図に示す。
硫黄は、火山の噴火や温泉からの排出によって自然に生成される。 主に二酸化硫黄の形で大気中に入り、その形のまま、あるいは水と反応して硫酸の形で大気中にとどまります。 雨や雪が降ると、硫黄は酸性雨として地表に運ばれてくる。
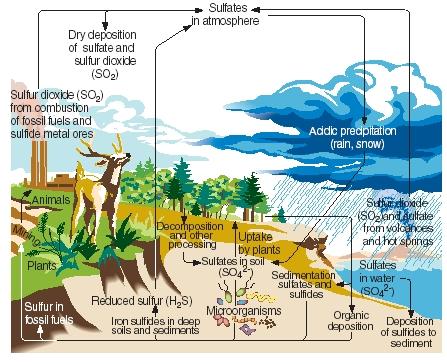
.)
地球の表面では、二酸化硫黄と硫酸が金属と反応して硫酸塩と硫化物を形成している。 また、この元素は有機硫黄として知られる形で植物に取り込まれる。 タンパク質の原料であるアミノ酸には、硫黄が含まれているものがあります。 植物から取り込まれた有機硫黄は、やがてその植物を食べた動物に受け継がれます。 硫黄は、植物性タンパク質から動物性タンパク質に変換されるのです。
植物や動物が死ぬと、硫黄は土に戻り、微生物によって硫化水素に変化します。 硫化水素ガスは大気中に戻され、酸化されて硫酸になります。
人間の活動は様々な形で硫黄循環に影響を及ぼしている。 例えば、石炭や金属鉱石が採掘されると、硫黄や硫化物が放出され、土壌に戻されることがあります。 また、石炭、石油、天然ガスが燃焼すると、しばしば大気中に二酸化硫黄が放出される。 この二酸化硫黄は、自然界に存在する量に加え、地表に降る酸性雨の量を大幅に増加させる。 酸性降水(または酸性雨)は、樹木やその他の植物の枯死、湖の酸性化による海洋動物の被害、金属や石の構造物の損傷、その他の環境への害に関係していると考える人々もいます。
セレン、テルル、ポロニウム
セレンとテルルは、どちらも比較的まれな元素です。 これらは、存在量の点で、すべての元素の下位 10 パーセントにランクされています。 これらは銅や他の金属の鉱石と一緒に地殻に存在する傾向があります。 どちらも銅の電解精錬の副産物として得られる。 電解精製の過程で、電解槽の底に沈み、発生するスラッジから除去することができる。
セレンはさまざまな同素体(同じ物質で物理的または化学的に異なる形態)で存在し、最も一般的なものは赤い粉末で、空気に触れると黒くなる。 この元素の融点は217℃(423°F)、沸点は685℃(1,265°F)である。 テルルは銀白色の固体で、金属のように見える(実際はメタロイドであるが)。 融点は450℃、沸点は990℃である。
セレンは生体内で興味深い役割を担っている。 ほとんどの動物の健康を維持するために、非常に低い濃度で必須です。 実際、動物の飼料によく添加されています。 しかし、高濃度では、奇形児や病気の成虫を引き起こすなど、動物に有害な影響を与えることが分かっています。
セレンの主な用途は、電子機器と色ガラスの製造です。 コピー機、太陽電池、光電池、テレビ画像管、電子整流器やリレー(電流の流れを制御するために使用)にはすべてセレンが使われています。 淡いピンクから鮮やかな赤まで、最も美しい色彩のガラスは、セレンの化合物で作られている。
色ガラスの製造には、少量のテルルも使用されています。 しかし、この元素の90%以上は、鉄や他の金属の合金の生産に使われています。
ポロニウムは27の同位体を持っており、そのすべてが放射性です。 ポロニウムはウラン鉱石中に自然に存在し、ウランが放射性崩壊を起こす長い一連の反応の最終生成物となります。 地球上で最も希少な元素の一つであり、その存在量は3×10 -10ppm以下である。 ポロニウムの発見は、1898年、ポーランド系フランス人の化学者マリー・キュリー(1867-1934)によるもので、科学史の中でも最もドラマチックな物語の一つである。 彼女は何トンものウラン鉱石を処理して、数ミリグラムの新元素を手に入れ、故郷ポーランドの名前をつけたのである。 ポロニウムは、宇宙衛星や宇宙探査機など、高度に特殊な発電装置に限定的に使用されている。