10.13: アボガドロの仮説とモル体積
Avogadro’s Hypothesis and Molar Volume
体積は品数、質量に続く物質の量を測る第三の方法です。 液体や固体の場合、体積は物質の密度によって大きく変化する。 これは、固体や液体の粒子は、粒子と粒子の間にほとんど空間がなく、互いに密着しているためです。
1811年にAmadeo Avogadroが、すべての気体の体積は容易に決定できることを説明しました。 アボガドロの仮説は、同じ温度と圧力のもとでは、すべての気体の体積は同じ数の粒子を含んでいるとするものです。 気体の体積は、主に粒子と粒子の間の空間から構成されているので、粒子そのものの大きさはほとんど無視できる。 水素のように粒子が小さい軽い気体の体積と、六フッ化硫黄のように粒子が大きい重い気体の体積は、同じ数だけあるのです。
気体は圧縮性を持っており、高い圧力をかけると粒子同士が接近して空隙が減り、気体の体積が小さくなる。 気体の体積は温度にも影響される。 気体を加熱すると、分子の動きが速くなり、気体は膨張する。 圧力と温度の変化によって気体の体積が変化するため、気体の体積の比較は、ある標準的な温度と圧力で行う必要があります。 標準温度・圧力(STP)とは、温度: \(0^text{o} ³)、圧力:1(atm} ³)と定義されています。 気体のモル体積は、STPにおける気体1モルの体積である。

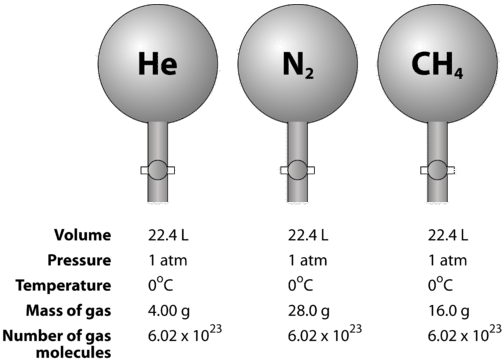
異なる気体を比較したときのモル体積の見え方を下図に示します。 ヘリウム⇄窒素⇄メタン⇄のサンプルは、STPにあります。 それぞれ1モル、㎤(6.02㎤×10^{23})の粒子が含まれています。 しかし、それぞれの気体の質量は異なり、その気体のモル質量に対応する。 \ただし、それぞれの気体の質量は異なり、その気体のモル質量に対応します。例えば(ce)Heの場合は(4.00)、(ce)N2の場合は(28.0)、(ce)CH4 の場合は(16.0)です。