4. 強塩基と弱塩基
弱塩基
アンモニアは典型的な弱塩基の一つです。 アンモニア自体は明らかに水酸化物イオンを含んでいませんが、水と反応してアンモニウムイオンと水酸化物イオンを生成します
ただし、この反応は可逆的で、いつでも約99%のアンモニアがアンモニア分子として存在しています。 実際に水酸化物イオンを生成したのは約1%だけである。 弱塩基とは、溶液中で水酸化物イオンに完全に変換されない塩基のことです。 弱塩基が水と反応するとき、平衡の位置は塩基によって異なる。
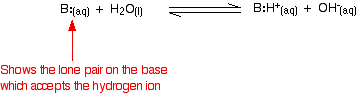
反応の平衡定数を書くことによって、平衡の位置を知ることができる。 定数の値が小さいほど、平衡は左側にある。 この場合の平衡定数はKbと呼ばれます。 これは次のように定義される。
\}{}\]
The relationship between Kb and pKb is exactly the same as all the other “p” terms in this topic:
\
The table shows some values for \(K_b\) and \(pK_b\) for some weak bases.
| base | Kb (mol dm-3) | pKb |
|---|---|---|
| C6H5NH2 | 4.17 x 10-10 | 9.38 |
| NH3 | 1.78 x 10-5 | 4.75 |
| CH3NH2 | 4.37 x 10-4 | 3.36 |
| CH3CH2NH2 | 5.37 x 10-4 | 3.27 |