Chemistry for Non-Major
学習目標
- 原子半径を定義する。
- 周期内で原子がどう変わるかを記述する。
- 原子半径がグループ内でどのように変化するかを説明しなさい。
どうしてこの人たちはこんな小さなスペースに入れるのでしょうか
 イベントには大勢の人が集まります。 屋外のイベントでも、人が入りきらないほどいっぱいになることがあります。 群集の収容力は会場の空間の量に依存し、空間の量はそれを満たす物のサイズに依存します。 ゾウは人よりも大きいので、ゾウよりも多くの人をあるスペースに入れることができます。 同じ理由で、人間よりもリスの方がたくさん入ることができます。
イベントには大勢の人が集まります。 屋外のイベントでも、人が入りきらないほどいっぱいになることがあります。 群集の収容力は会場の空間の量に依存し、空間の量はそれを満たす物のサイズに依存します。 ゾウは人よりも大きいので、ゾウよりも多くの人をあるスペースに入れることができます。 同じ理由で、人間よりもリスの方がたくさん入ることができます。
原子の大きさは、原子または化合物の動作を説明しようとするときに重要です。 原子の大きさを表す方法の 1 つに、原子半径があります。
原子の大きさは、原子の軌道の端によって定義されます。 しかし、軌道の境界はあいまいで、実際、さまざまな条件下で変化します。 そこで、原子半径の測定を標準化するために、同じ原子を2つ結合させたときの原子核の距離を測定することにした。

図1.原子核の距離。
原子の半径は、二原子分子の2つの原子核間の距離(d)の半分と定義できます。 原子半径の単位はピコメートルで、10~12メートルに相当する。 例えば、H2分子の2つの水素原子間の核間距離は74pmと測定されています。
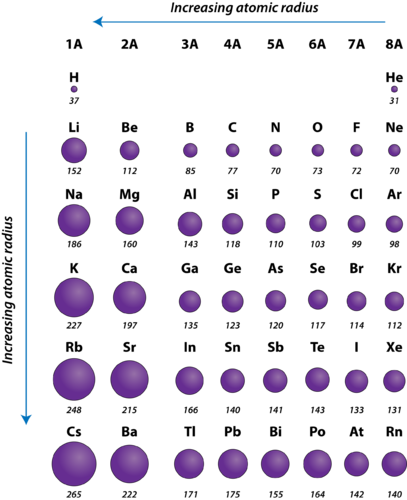
図2. ピコメートル単位で測定した代表的な元素の原子半径
周期的な傾向
原子の半径は一般的に周期をまたいで左から右に減少していきます。 酸素の半径が窒素の半径よりわずかに大きいなど、いくつかの小さな例外はあります。 周期内では、同じ主エネルギー準位に電子が追加されると、陽子が原子核に追加される。 これらの電子は、正電荷が増加するため、次第に原子核に引き寄せられる。 原子核と電子の間の引力が増加するため、原子の大きさは小さくなる。
グループの傾向
原子の半径は、一般にグループ内で上から下へ向かって大きくなります。 原子番号がグループの下方に増加すると、正の核電荷が再び増加します。 しかし、占有される主要なエネルギー準位の数も増加します。 高い主エネルギー準位は、低いエネルギー準位の軌道よりも大きなサイズの軌道で構成されている。

図3.原子核の半径は、主エネルギー準位の数の増加により、核電荷の増加よりも大きくなり、グループの下に向かって大きくなっていくことがわかる。 A graph of atomic radius plotted versus atomic number. Each successive period is shown in a different color. As the atomic number increases within a period, the atomic radius decreases.
Summary
- Atomic radius is determined as the distance between the nuclei of two identical atoms bonded together.
- The atomic radius of atoms generally decreases from left to right across a period.
- The atomic radius of atoms generally increases from top to bottom within a group.
Practice
Use the link below to answer the following questions:
http://chemwiki.ucdavis.edu/Inorganic_Chemistry/Descriptive_Chemistry/Periodic_Table_of_the_Elements/Atomic_Radi
- What influences the atomic size of an atom?
- What is a covalent radius?
- What is an ionic radius?
Review
- Define “atomic radius.”
- What are the units for measurement of atomic radius?
- How does the atomic radius change across a period?
- How does atomic radius change from top to bottom within a group?
- Explain why the atomic radius of hydrogen is so much smaller that the atomic radius for potassium.