H2S Lewis Structure, Molecular Geometry, Hybridization and Polarity
Hydrogen Sulfide is a common chemical compound that is useful for analyzing inorganic compounds of metal ions. It has the chemical formula of H2S. The molecule has two Hydrogen atoms and a single Sulfur atom. H2S is also a precursor for elemental Sulfur. It also plays a vital role in signaling pathways in the human body. So to understand the hybridization, polarity, and molecular geometry of this compound, it is essential to know its Lewis structure.
| Name of molecule | Hydrogen Disulfide ( H2S) |
| No of Valence Electrons in the molecule | 8 |
| Hybridization of CO2 | sp3 hybridization |
| Bond Angles | 104.5 degrees |
| Molecular Geometry of CO2 | Bent |
Before knowing its Lewis structure, let us calculate the total number of valence electrons in Hydrogen Sulfide as these electrons participate in bond formation and help us study Lewis structure with ease.
Contents
Valence electrons of H2S
To know the total number of valence electrons in Hydrogen Sulfide we need to add the valence electrons of both Hydrogen and Sulfur atoms. There are two atoms of Hydrogen and a single atom of Sulfur in the compound.
Each Hydrogen atom has only one electron which is also its valence electron
Hence there are two valence electrons for Hydrogen atom ( as there are two Hydrogen atoms)
Sulfur has six valence electrons.
Total number of valence electrons in H2S
= 2(1) + 6
= 8
Thus, there are a total of eight valence electrons in H2S.
H2S のルイス構造
あらゆる化合物のルイス構造は、非結合電子対とともに結合の形成に関与する価電子を構造的に表したものです。 与えられた化学化合物のルイス構造を知ることは、その化合物の他のすべての化学的特性に関する必要な情報を提供するため、不可欠です。
表現は、電子を表す点と線を使って表示されます。 ドットは、結合形成に関与しない電子を表します。 一方、線は化合物の結合を表します。 構造は「オクテット則」に基づいて作られる。
硫化水素のルイス構造は、簡単に描けて理解できます。
硫化水素のルイス構造は描きやすく、理解しやすい。この化合物では、硫黄と共有結合するために両方の水素原子が1個の電子を必要とするのである。 H2S のルイス構造は H2S と似ています。 硫黄はオクテット則の要件を満たすために8個の電子を必要とします。
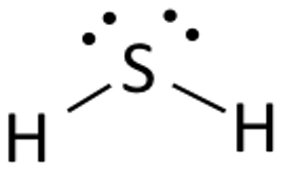
硫黄原子を真ん中に置き、その周りに価電子を並べます。
次に中心原子の両側に水素原子を2つ置きます。
ここで硫黄の価電子は、水素の両方の原子に電子を与えて水素を安定させるために使われます。
水素原子と硫黄原子の間に線(結合を表す線)を引きます。
残りの4つの電子は非結合電子なので、硫黄原子の近くに点として表示されます。 この化合物には合計で2組の非結合電子があり、水素原子は完全な価電子帯を持ちます。
H2S
H2Sの混成を理解するために、まず2つのことを知ることが重要です。
- その化合物の結合数とタイプ
その混成を知るために、化合物の結合の種類を知ることが不可欠です。 H2S分子では、2つの水素原子が中心の硫黄原子と結合を形成している。 分子内に2つの単結合が形成されています。 これらの結合は4個の価電子を占有するため、他に4個の価電子が残ります。 水素原子のs軌道は結合を形成する際に硫黄原子のp軌道と重なります。 単独電子対はsp3軌道のうち2つを占めます。
この配置により、H2S分子はsp3混成軌道となる。
- 与えられた化合物の立体数
立体数は、中心原子の周囲に見られる電子密度の領域として定義されます。 この場合、硫黄が中心原子なので、化合物の立体数は、中心原子に結合している原子の累積合計と、中心原子の周りの電子の孤立対の数になります。
この数を求める公式は次のとおりです。
立体数 (SN)
=中心原子のシグマ結合数 + 中心原子のパイロン対数
この H2S 分子の場合、シグマ結合が 2 つあり、中心原子の電子対が 2 つある。

したがってH2S分子のSN=2+2
=4
H2Sの立体数は4なので、2
ハイブリッド軌道と孤立電子2組がありsp3混成であることがわかります。
分子のルイス構造と混成がわかったので、分子形状を決めるのは簡単です。
H2S 分子形状
与えられた分子 H2S の混成は sp3 で、硫黄原子は中心で 2 つの水素原子と結合し、結合角は 180 度未満になるようにします。 VSEPR 理論によると、孤立電子対は互いに反発しますが、硫黄原子は電気陰性度が低いので、結合角は 104.5 度まで減少します。
この角度の減少は、曲がった構造をもたらします。
分子幾何学を知るもうひとつの方法は AXN 法です。 ここで、Aは中心原子、Xは結合電子の数、Nは孤立電子の数を表します。 ここでは、結合電子が2対、孤立電子が2対あるため、一般式はAX2N2となります。
H2S の極性
分子に関する必要な情報が得られたので、その極性を決定するのは簡単です。 任意の分子の極性は、その分子形状と全体の電気陰性度に依存します。
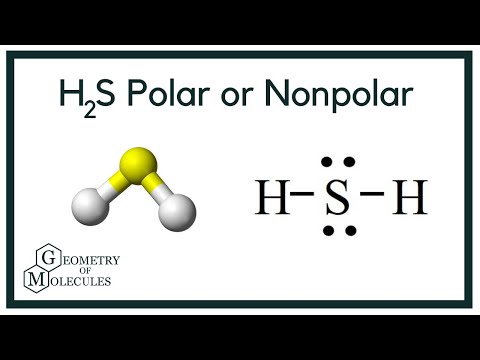
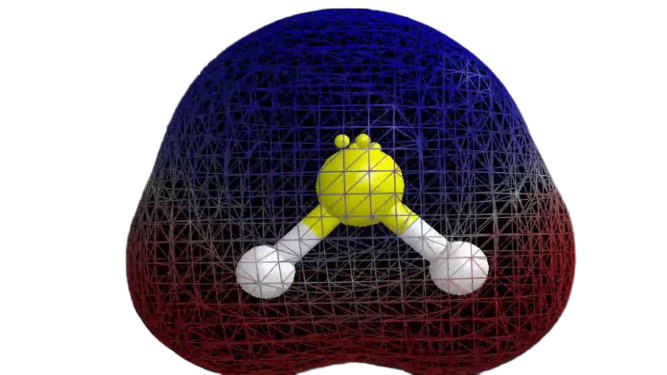
まとめ
以上の情報から、H2S 分子は 8 価電子、sp3 混成、曲がった分子形状、および非極性であると結論付けることができます
H2S 分子には 8 価電子があり、sp3 混成、および非極性であることがわかります
 。
。