Principles of Biology
化学反応では、エネルギーを蓄積する結合が壊れるとエネルギーが放出されることを学んだら、次に重要な疑問がわき起こります。 これらの化学反応に伴うエネルギーは、どのように定量化され、表現されるのでしょうか。 ある反応から放出されるエネルギーは、他の反応のエネルギーとどのように比較できるのだろうか。 このようなエネルギー移動を定量化するために、自由エネルギーの測定が行われる。 熱力学の第二法則によると、すべてのエネルギー移動には、熱のような使用不可能な形でいくらかのエネルギーが失われることを想起してください。 自由エネルギーとは、化学反応に伴うエネルギーのうち、損失分を考慮した上で利用可能なものを指す。 つまり、自由エネルギーとは「使えるエネルギー」であり、「仕事をするのに使えるエネルギー」なのである。 この概念を生物学的に見ると、自由エネルギーは、仕事をするために使用できる分子内のエネルギーである。 グルコースは、グルコース分子の結合の中に多くのエネルギーを蓄えているため、多くの自由エネルギーを持っている。
化学反応中にエネルギーが放出されると、反応物から生成物への変換による自由エネルギーの変化量ΔG(デルタG)は負数になります。 自由エネルギーの変化が負になるということは、反応中に自由エネルギーを放出するため、反応の生成物が反応物より自由エネルギーが少ないことも意味する。 自由エネルギーが負に変化し、その結果自由エネルギーが放出される反応を「エクセルゴニック反応」と呼びます。 考える:エクセルゴニックとは、エネルギーが系から出ることを意味する。 これらの反応は自発的反応とも呼ばれ、その生成物は反応物よりも蓄積エネルギーが小さくなります。 自然発生的という言葉と、化学反応がすぐに起こるという考え方は、重要な区別をしなければなりません。 日常的に使われている言葉とは逆に、自然発生的な反応とは、突然、あるいはすぐに起こるものではありません。
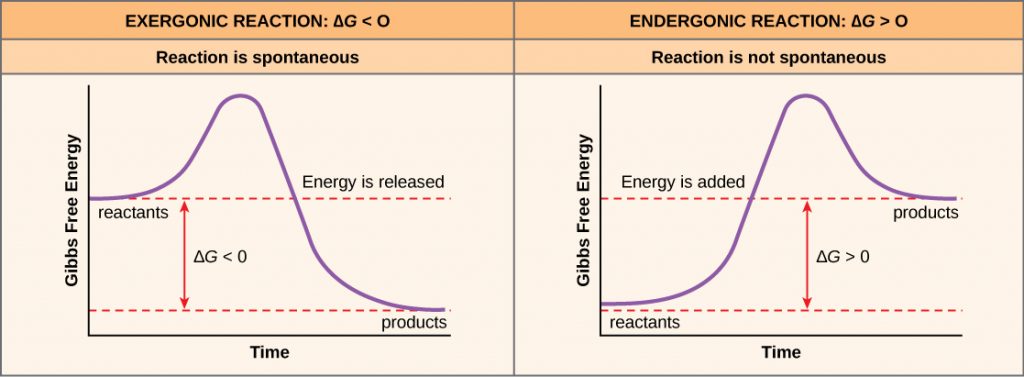
化学反応がバランスよくエネルギーを放出するよりもエネルギーを吸収する場合、その反応のΔGは正の値になる。 この場合、生成物は反応物よりも自由エネルギーが大きい。 したがって、このような反応の生成物は、エネルギーを蓄える分子と考えることができる。
エンドゴニック反応は、自由エネルギーを加えなければそれ自体では起こりません。

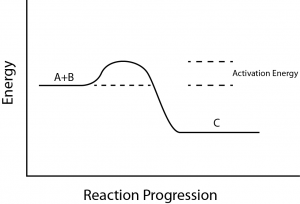
endergonic および exergonic 反応について考慮しなければならないもう 1 つの重要なコンセプトがあります。
これらの反応では、エネルギーが正味で放出されますが、それでも最初にいくらかのエネルギー入力が必要です。
特に断りのない限り、このページの画像はOpenStaxによるCC-BY 4.0のライセンスです。
テキストはOpenStax、Concepts of Biologyを基に作成しています。 OpenStax CNX. 2016年5月18日 http://cnx.org/contents/[email protected]
http://cnx.org/contents/[email protected]