UTI – 従来の培養検査は時代遅れか?
掲載日。 2020年3月
尿路感染症は最も一般的な細菌感染症であり1、米国では年間少なくとも1100万人の医師の診察、200~300万人の救急部訪問、40万人の入院、約23億ドルの医療費の原因となっています2,3,4,5。 えば、高齢化の進展や抗菌薬耐性菌の増加により、尿路感染症による集中治療の必要性や院内死亡率が高まっています6,7。 しかし、新しい検査方法や尿中マイクロバイオームに関する新たな理解は、従来の尿培養の妥当性に疑問を投げかけています。 本稿では、主な尿路感染症の種類、尿培養と感度検査の使用に関する現在のアプローチ、尿中マイクロバイオームに関する最近のエビデンス、市販の新規検査、新規バイオマーカーや機械学習アルゴリズムなどの尿路感染症検出に関する今後のアプローチについて概説する。
非合併型尿路感染症と合併型尿路感染症
合併型尿路感染症かどうかを区別することは管理を導く上で必須の最初のステップである。 非合併型尿路感染症は、プライマリケア環境において最もよく治療される感染症の一つです。 女性は最もリスクが高く、生涯発症率は50%に迫り、再発率は約33%です。8
合併症のない尿路感染症の患者の大半は、妊娠していない閉経前の女性で、合併症はほとんどありません。 これらの患者は一般的に排尿困難、頻尿、切迫感などの膀胱炎の症状を呈します。9 恥骨上部の痛みや血尿はまれで、腎盂腎炎は認められません。
合併症性尿路感染症は、一般的に尿路の構造的または機能的な異常がある男女の患者が罹患します。9 これらの患者は、泌尿器科手術の既往、最近の抗生物質への曝露、最近または長期のカテーテル挿入、最近または現在の入院(院内尿路感染症)を有する場合が多くみられます。 その他、妊娠中の女性、糖尿病患者、免疫不全の患者なども高リスク群に含まれます。
複雑性尿路感染症の患者は、一般的に発熱、悪寒、脇腹痛などの腎盂腎炎の症状を呈し、吐き気を伴うか伴わないかを問わず、発症します。 また、より毒性の強い細菌による感染歴が確認されている、あるいは疑われている場合もあります。 尿培養により、多様な微生物相と平均以上の抗菌薬耐性パターンが明らかになることがある。
尿培養を考慮するタイミングと感度
歴史的に、尿路感染症の診断のゴールドスタンダードは、標準的な尿培養(すなわち、1マイクロリットルの中流尿を5%羊腸血液とマコンキー寒天培地に広げ、好気的に培養する)を行うことであった。1 この文脈では、尿路感染症は、症状のある患者において、>105 CFU/mlまたは>102 CFU/mlの濃度で、分離した既知の尿路病原体が存在すると定義されていた。 尿路感染症の高い有病率と尿培養がポイントオブケア検査でないことを考慮すると、治療成績を損なわずに培養を見送ることが可能な場合は検討する価値があります。
米国感染症学会(IDSA)の現在のガイドラインでは、合併症のない尿路感染症が疑われる患者に対して、標準的な尿培養のルーチンは推奨されていません10。 ある研究では、尿検査が陰性の患者の約94%が培養も陰性でした。11 女性外来患者約21,000人を対象とした縦断的レトロスペクティブ研究では、尿検査陰性は陽性と比較して培養陰性(<103 CFU/ml)の確率が約2.5倍高くなりました(12)。 尿路感染症の症状が再発した患者では、過去に尿検査または尿培養が陰性であったこと、または現在膣に炎症や分泌物があることが、培養陰性の確率を統計的に有意に増加させることに関連しました。
白血球エステラーゼは、合併症のない尿路感染症が疑われる場合に、特に有益な検査です。 8,500人以上の患者を対象とした大規模なレトロスペクティブ研究では、白血球エステラーゼが陰性であれば、尿培養の陰性結果を95%の精度で予測できました(陰性的中率、0.95)13。
合併症のない尿路感染症患者に対して、IDSAガイドラインは経験的抗菌療法に以下の薬剤の中から選択することを推奨しています。10
– ニトロフラントイン 100mg 1日2回(BID)、5日間
– トリメトプリム/スルファメトキサゾール(バクトリムDS)、3日間(地域の耐性率が<20% であれば(これらのデータをまだ入手していない場合、地域、郡、州の保健所に問い合わせを検討)
– ニトロフラントイン100mg 1日2回(BID)、3日間(BSD)。
– ホスホマイシン(3グラム単回投与)
– シプロフロキサシンなどのフルオロキノロン系は、地域によっては耐性率が高く、合併症のない尿路感染症にはもはや推奨されないことに注意
さらに、合併症のない尿路感染に対する抗菌治療の選択は、地域の抗菌性パターンおよび臨床医の最善の、情報に基づいた推測によって導かれるべきものです。 9,000人以上の培養確認された女性患者を対象とした研究では、トリメトプリム・スルファメトキサゾールに19%、ニトロフラントインに12%が耐性を示した(シプロフロキサシンは10%で、経験的治療として推奨されなくなった)。14 抗菌薬耐性の有意な予測因子としては、抗菌薬耐性率が平均以上の郵便番号に住んでいること、耐性尿路感染症の既往があること、過去2年以内に抗菌薬療法を処方されたことなどが挙げられた。 これらのデータに基づき、研究者らはアルゴリズムを開発し、医療従事者の選択率87.5%を上回る92%の症例で適切な抗菌薬療法を選択した。
結論として、合併症のない尿路感染症患者にとって、従来の尿培養は時代遅れではなく、ほとんどの場合、不要である。
複雑性尿路感染症が疑われる患者に対しては、臨床医は、現在の尿検査の結果や抗菌薬耐性の地域パターンに加え、過去の培養と感度のデータがあればそれをもとに初期(経験的)抗菌薬療法を選択すべきです。 尿検査が陰性で、過去に培養が陰性であった履歴がある場合、最近のデータによると、現在の症状が尿路感染症によって引き起こされていない可能性が87%である12。このような患者は、慢性骨盤痛症候群(CPPS)や尿路の腫瘍など、症状の他の原因について評価する必要がある。
尿は無菌ではありません。
ごく最近まで、合併症のない感染症も合併症のある感染症も、尿路から微生物を排除することが管理の基本でした。
このような状況下において、「無症候性(健康な)尿路にも微生物が存在する」「標準的な培養では尿路の微生物の検出が難しい」という2つの要因から、このアプローチには限界があると専門家たちは認識しています。 近の研究では、26歳から90歳までの健康な男女16人の尿検体から16SリボソームRNAの定量PCRを実施しました。 別の研究では、標準尿培養が陰性であった女性8人の尿サンプルを対象に、ハイスループットPCRシーケンス解析を行いました17。すべてのサンプルが多菌性であり、検体間でかなりのばらつきがありました。 同様の研究により、この所見は確認されており18、健康な人の尿には、標準的な尿培養では検出されない細菌が頻繁に含まれていることが示唆されている。 9 この方法では、より大量の尿をプレーティングし、より幅広い増殖条件下で検体を培養し、より長い培養期間を使用します。 EQUCで評価した65検体のうち、80%は細菌が増殖し、そのうち92%は標準培養では検出されなかった。 その結果、35の属が同定され、そのうちLactobacillus、Corynebacterium、Streptococcus、Actinomyces、Staphylococcusが最も多く検出された。 ほとんどの細菌種は、標準的な尿培養プロトコルの検出閾値以下の数まで複製された。 これらの知見は、150人の成人(半数が排尿症状を訴えている)を対象とした最近の別の研究でも確認され、EQUCの使用により、標準培養で検出された数の3倍にあたる182の尿路病原体が検出されました20。
これらの研究の結果を総合すると、健常者と排尿症状を訴える患者の両方に多様な尿中細菌叢が存在し、標準尿培養法は尿路病原体を含むこの微生物群の特徴を把握するのに比較的非感受性であるということが確認できます。 また、標準的な培養では、尿道カテーテル内に形成されるようなバイオフィルムを確実にシミュレートできず、標準的な培養と感度測定の最終結果を報告するには日数を要します11,21。 明らかに、改善の余地がある。
尿路感染症のための新しい市販の検査
3つの市販の尿検査は、標準的な尿培養よりも高い感度で尿路病原体を検出し、抗菌剤耐性の証拠を迅速にスクリーニングする(表1)18、19、22 これらの検査の潜在的利点には、病原体の迅速な特定、より正確な感度結果、個人に合わせた治療があり、これらは理論的に患者の治療成績を改善できる23、24、25。
Vikor Urine-ID™テストは、複数の細菌種を検出できるPCRベースのアッセイで、抗菌剤に対する耐性をコード化する最大30個の細菌遺伝子も特定できます。26 検査結果は、約12時間から24時間で得られます(表1)。 検査結果とともに、地域の抗菌薬感受性パターン、抗菌薬の活性スペクトル、薬剤費、米国食品医薬品局(FDA)の関連ガイダンスに関する情報も提供されます。
マイクロジェンDX UTI尿検査キットは、2ステップの検査です27。まず、定量PCR法により、16種類の細菌とカンジダ・アルビカンスをスクリーニングし、24時間以内に結果を提供します。 次に、次世代シーケンサー(NGS)を用いて、尿検体から得られた微生物相DNAを3万種以上の微生物データベースと比較し、3~5日で結果を得ることができる(表1)。 メーカーによると、UTI尿検査キットは、99.9%の精度で尿検体中のすべての微生物を同定するとのことです。
表1. 尿路感染症の新規市販検査の概要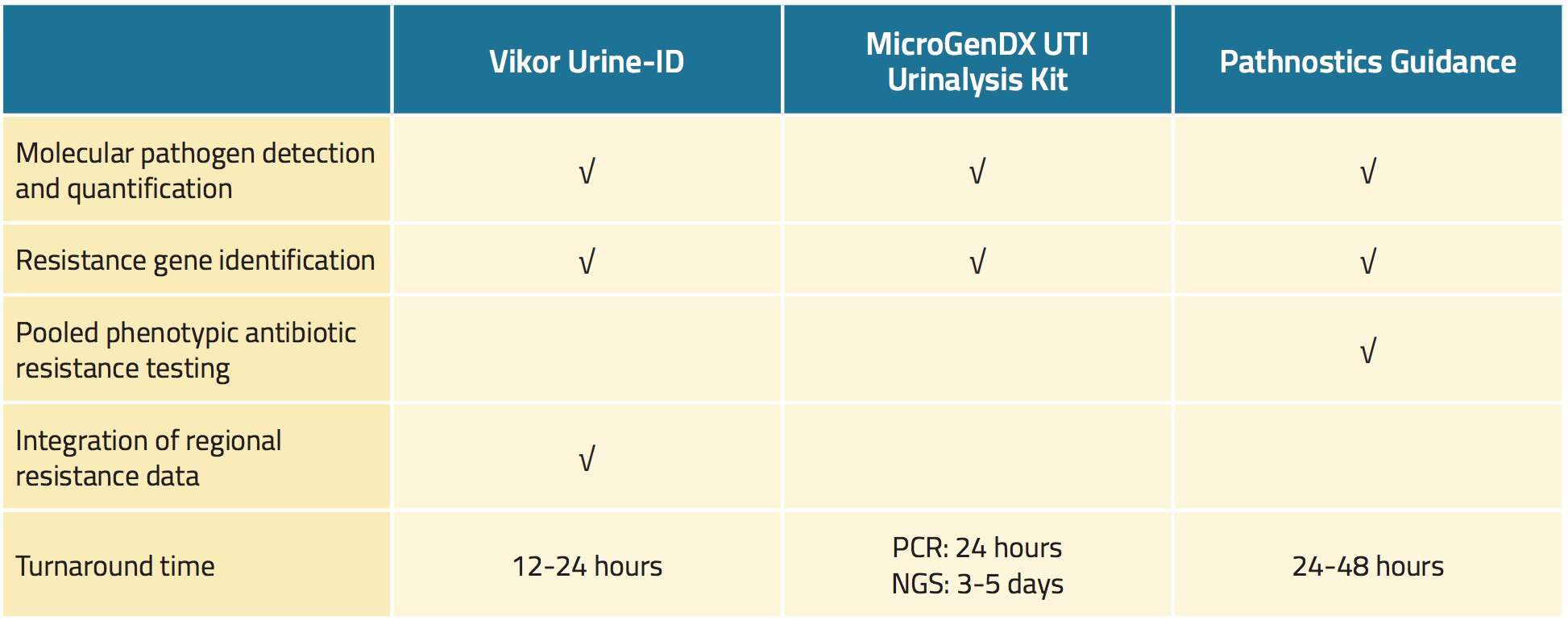
Pathnostics Guidance assayは、前立腺炎、間質性膀胱炎、再発性尿路感染症の患者に対する一連の新規尿検査からなります28。 Pathnostics Guidanceアッセイは、表現型データおよびプールされた抗菌薬感受性の結果も生成します。 この検査では、室温で最大5日間保存可能な排尿またはカテーテル尿を使用することができます。 結果は24時間から28時間以内に得られます。
1つだけ注意点があります。 これまで述べてきたように、これらの高感度検査は、無症状の人や尿路感染症とは無関係な症状の人の尿からも細菌を検出することができます。 したがって、臨床医は検査結果だけで治療を決定してはならない。 そうすれば、患者にとって不都合な結果を招きかねない。 無症候性細菌尿を有し、尿路感染症を再発したことのある若年・中年女性673人を対象としたある研究では、患者の半数が抗菌薬療法を受け、残りの半数は受けなかった22。6ヵ月および12ヵ月後の追跡調査では、抗菌薬療法は尿路症状の再発率を統計的に有意に高めることと関連していた。 抗菌薬の過剰使用とそれに伴う副作用、コスト、耐性菌の選択を避けるためには、臨床医が患者の尿路感染症のリスクや既往歴、現在の臨床症状との関連で検査結果を評価することが極めて重要である。
尿検査における今後の方向性
最近承認された検査は、標準的な培養のみと比較して、尿路感染症の検出と管理を大幅に改善する勢いですが、研究者は診断、病原菌検出、抗菌剤感度の定量化、治療アルゴリズムを改善する方法を模索し続けています。 その例として、機械学習技術の利用、新規バイオマーカーの複合分析、細胞タンパク質のシグネチャーの検査などが挙げられる。
機械学習アルゴリズムは、合併症のない尿路感染症患者の検出と評価の改善に早くから有望視されている。 例えば、ある研究では、17の臨床変数と42の免疫学的変数を評価し、尿培養の結果の最良の予測因子を特定した。 尿の濁り(turbidity)が最も優れた臨床的予測因子であり、陽性予測値は0.65(尿の濁りの有無が培養陽性検体を65%の精度で識別することを意味する)、陰性予測値は0.5であった。29 したがって、尿の濁りは比較的感度が低いが、培養陽性検体の検出には妥当な特異性を示すことが確認された。 尿中バイオマーカー(マトリックスメタロペプチダーゼ9、好中球ゼラチナーゼ関連リポカリン、インターロイキン(IL)-8、IL-1β)は、陽性的中率0.82と非常に高く、陰性的中率0.76と同程度であった。 これら4つの尿中バイオマーカーと尿濁度を組み合わせても、これらの予測値はそれ以上向上しなかったが、この研究結果は、機械学習アルゴリズムが合併症のない尿路感染症患者のほとんどを確実に識別できることを示している29
機械学習モデルがより洗練されれば、その予測値が向上し、脆弱な集団における尿路感染症の診断と治療がさらに向上すると同時に診断業務量が軽減できるかもしれない。 例えば、最近の大規模研究では、英国の3つの病院と外来診療所から報告された212,000件以上の尿の顕微鏡検査、培養、感度の結果を分析した30。特定の機械学習アルゴリズムは、妊婦、子ども、持続性または再発性尿路感染症の患者などの高リスクのサブグループ向けに設計されていた。 機械学習は、培養陽性の検体の約95%を検出する一方で、尿培養に伴う作業負荷を約41%削減し、白血球数と細菌数に基づくヒューリスティックモデルよりも約24%高い特異度を達成しました。 高齢化や抗菌薬耐性菌の出現により、治療が必要な尿路感染症を効率的かつ正確に検出する必要性が高まっている現在、これらの結果は特に注目されます。
再発性尿路感染症(歴史的に過去6ヶ月間に2回以上、または過去1年以内に3回以上の尿路感染症と定義)は、55歳以上の女性で約50%、若年女性で27%であることが分かっています31, 32 現在のガイドラインでは、抗菌薬の予防投与、殺精子剤の使用制限、性交後の排泄、OM-89による免疫予防、ウロバックによる膣ワクチン接種、産後の女性への膣エストロゲンクリームやリングの使用などの対策で集中的に管理することが求められている31.5。 33 血清と尿のバイオマーカーを分析することで、どの患者が尿路感染症を再発するかをより適切に予測し、より早期に的を絞った介入を受けられるようになるかもしれない32。 尿路感染症再発の関連バイオマーカーとしては、血清中のビタミンDおよび前立腺特異抗原の低下、血清中の免疫グロブリン、顆粒球コロニー刺激因子、マクロファージコロニー刺激因子およびIL-5の増加、尿中バイオマーカーとしてはIL-8の上昇、神経成長因子および好中球ゼラチナーゼ関連リポカリン濃度の低下が挙げられる。
将来の診断法としては、尿培養の必要性を補う、あるいは減らすためのポイント・オブ・ケアバイオマーカーアッセイも含まれるかもしれません。 理想的な分析法は、尿検査と同じくらい迅速で安価でありながら、より正確で精度の高いものである。 34
将来的には、尿路感染症のバイオマーカーとして、尿中エキソソームも評価されるかもしれない。 エクソソームは、細胞タンパク質を運ぶ小さな細胞外小胞で構成されている。 ある研究では、尿路感染症の女性では、Akt(細胞内シグナル伝達タンパク質)とCD9(細胞内膜貫通タンパク質)が無症候性細菌尿の女性と比較して有意に上昇し、両タンパク質のレベルは抗菌療法後に有意に減少した35。 このような研究結果は、いつの日か、治療の意思決定に役立つ尿中エキソソームを評価する市販のアッセイの開発を促進する可能性がある。
まとめ
尿路感染症の評価と管理は、泌尿器科診療において不可欠である。 合併症のない尿路感染症では、一般的に尿培養は不要であり、現在のIDSAガイドラインに従った経験的治療が適切である。 複雑性尿路感染症では、過去の培養と感度の結果に基づく経験的治療も適切であるが、現在の培養と感度に基づき修正する必要がある。 尿路感染症が再発した場合は、集中的な治療と行動療法が必要である。
これらは現在のベストプラクティスですが、特に尿中マイクロバイオームの存在を示す最近のエビデンスや、標準的なスクリーニングや培養の限界を考えると、改善の余地がかなりあります。 尿路病原体の検出、臨床的に意義のある尿路性状異常と臨床的に重要でない細菌尿の鑑別、個人に合わせた耐性データに基づく抗菌治療の指針として、迅速で信頼性の高い検査法が求められています。 現在、定量PCRや次世代シーケンサーに基づく感度測定が可能になっている。 将来的には、より高度な定量的尿培養法の使用により、臨床治療が改善される可能性もある。 また、血清や尿中のバイオマーカーやその他の臨床的な変数を組み込んだ機械学習アルゴリズムが、より効果的に尿路感染症を検出し、再発を予測し、診断の負担を軽減することも検討されている。 これらの新しいアプローチに局所耐性や病院の再入院データを組み込むことで、その有用性がさらに高まる可能性があります。 最終的な目標は、感度が高く、特異的で、費用対効果の高い検査と、管理および患者の転帰を改善する実用的なアルゴリズムを開発することです」
執筆者:小林聡子 Edward Schaeffer, MD, Ph.D., Chair, Department of Urology, Feinberg School of Medicine, Program Director, Genitourinary Oncology Program, Robert H. Lurie Comprehensive Cancer Center, Northwestern University, Chicago, Illinois<br><br>1. シェーファー、AJ.、マトゥレヴィッチ、RS.、& Klumpp、DJ.Schaeffer、AJ.、Matulewicz、RS. (2016). 尿路の感染症. でAJ. Wein, & et al (Eds.), Campbell-Walsh Urology, Eleventh Edition Philadelphia:
2. Schappert, S. M., and E. A. Rechtsteiner. “2007年の外来医療利用推計”. Vital and Health Statistics. シリーズ13、国民健康調査からのデータ169(2011):1-38.
3。 フォックスマン、ベッツィ。 “尿路感染症症候群:発生、再発、細菌学、危険因子、および疾患負担”. 北米感染症クリニック 28, no.1 (2013): 1-13.
4. Foxman, Betsy. “The epidemiology of urinary tract infection”. Nature Reviews Urology 7, no.12 (2010): 653.
5. Simmering, Jacob E., Fan Tang, Joseph E. Cavanaugh, Linnea A. Polgreen, and Philip M. Polgreen. “The increase in hospitalizations for urinary tract infections and the associated costs in the United States, 1998-2011” (米国における尿路感染症の入院の増加と関連コスト)。 オープンフォーラム感染症、vol.4、No.1にて。 Oxford University Press, 2017.
6. Nguyen, Hoa Q., Nga TQ Nguyen, Carmel M. Hughes, and Ciaran O’Neill. “尿路感染症(UTI)の高齢入院患者に対する抗菌薬耐性の動向と影響。 全国規模の後方視的観察研究。” PloS one 14, no.10 (2019).
7. Critchley, Ian A., Nicole Cotroneo, Michael J. Pucci, and Rodrigo Mendes.(クリッチリー、イアンA、ニコル・コトロネオ、マイケル・J・プッチ、ロドリゴ・メンデス). “2017年の米国における大腸菌の尿路分離株における抗菌薬耐性の負担”. PloS one 14, no.12 (2019).
8.Gupta, Kalpana, and Barbara W. Trautner.(グプタ、カルパナ、バーバラ・W・トラウトナー)。 “非妊娠女性における再発性尿路感染症の診断と管理” Bmj 346 (2013): f3140.
9. Tan, Chee Wei, and Maciej Piotr Chlebicki. “成人における尿路感染症” Singapore medical journal 57, no.9 (2016): 485.
10. Gupta, Kalpana, Thomas M. Hooton, Kurt G. Naber, Björn Wullt, Richard Colgan, Loren G. Miller, Gregory J. Moran et al. “International clinical practice guidelines for the treatment of acute uncomplicated cystitis and pyelonephritis in women: a 2010 update by the Infectious Diseases Society of America and the European Society for Microbiology and Infectious Diseases “女性用急性膀胱炎および腎盂炎の治療に関する国際臨床診療ガイドライン。 臨床感染症 52, no. 5 (2011): e103-e120.
11. Huang, Bin, Lei Zhang, Weizheng Zhang, Kang Liao, Shihong Zhang, Zhiquan Zhang, Xingyan Ma et al. “Direct detection and identification of bacterial pathogens from urine with optimized specimen processing and enhanced testing algorithm.” translated by Huang, Bin, Lei Zhang, Weizheng Zhang, Shihong Zhang, Shimyan Ma 他 ジャーナル・オブ・クリニカル・マイクロバイオロジー 55, no. 5 (2017): 1488-1495.
12. Cohen, Jason E., Emily M. Yura, Liqi Chen, and Anthony J. Schaeffer.(コーエン、ジェイソン・イー、エミリー・M・ユラ、リチ・チェン、アンソニー・J・シェーファー)。 “合併症のない尿路感染症の再発が疑われる女性における事前の尿培養陰性の予測的有用性”. ザ・ジャーナル・オブ・ウロロジー 202, no. 5 (2019): 979-985.
13. Marques, Alexandre Gimenes, Jacyr Pasternak, Márcio dos Santos Damascena, Carolina Nunes França, and Marinês Dalla Valle Martino.の各氏。 “尿培養陰性の予測因子としてのディップスティック・スクリーニング・テストの性能” Einstein (São Paulo) 15, no.1 (2017): 34-39.
14. Cohen, Jason E., Liqi Chen, and Anthony J. Schaeffer.(コーエン、ジェイソンE.、リチ・チェン、アンソニー・J・シェーファー)。 “以前の耐性、以前の抗菌薬処方、および患者の居住地を使用するアルゴリズムは、合併症のない尿路感染症の女性に対する経験的治療を強化する”. Urology 137 (2020): 72-78.
15. Finucane, Thomas E. “‘Urinary tract infection’ and the microbiome.”(「尿路感染症」とマイクロバイオーム)。 アメリカン・ジャーナル・オブ・メディシン 130, no. 3 (2017): e97-e98.
16. Lewis, Debbie Ann, Richard Brown, Jon Williams, Paul White, Susan Kim Jacobson, Julian Marchesi, and Marcus John Drake.(ルイス,デビー・アン,リチャード・ブラウン,ジョン・ウィリアムズ,ポール・ホワイト,スーザン・キム・ジェイコブソン). “ヒト尿中マイクロバイオーム;無症状成人の排泄尿中の細菌DNA”. Frontiers in cellular and infection microbiology 3 (2013): 41.
17. Siddiqui, Huma, Alexander J. Nederbragt, Karin Lagesen, Stig L. Jeansson, and Kjetill S. Jakobsen. “16S rDNAアンプリコンのハイスループットシークエンスによる女性尿微生物叢の多様性の評価”. BMC microbiology 11, no.1 (2011): 244.
18. Wolfe, Alan J., Evelyn Toh, Noriko Shibata, Ruichen Rong, Kimberly Kenton, MaryPat FitzGerald, Elizabeth R. Mueller et al. “Evidence of uncultivated bacteria in the adult female bladder.” (成人女性の膀胱における未培養細菌の証拠)。 ジャーナル・オブ・クリニカル・マイクロバイオロジー 50, no. 4 (2012): 1376-1383.
19. Hilt, Evann E., Kathleen McKinley, Meghan M. Pearce, Amy B. Rosenfeld, Michael J. Zilliox, Elizabeth R. Mueller, Linda Brubaker, Xiaowu Gai, Alan J. Wolfe, and Paul C. Schreckenberger.「成人女性の膀胱における未培養菌の証拠」Journal clinical microbiology 50 no.4 (2012): 1376-1383.
19. “尿は無菌ではない:成人女性の膀胱における常在細菌叢を検出するための強化された尿培養技術の使用。” ジャーナル・オブ・クリニカル・マイクロバイオロジー 52, no. 3 (2014): 871-876.
20. Price, Travis K., Tanaka Dune, Evann E. Hilt, Krystal J. Thomas-White, Stephanie Kliethermes, Cynthia Brincat, Linda Brubaker, Alan J. Wolfe, Elizabeth R. Mueller, and Paul C. Schreckenberger.の各氏。 “The clinical urine culture: enhanced techniques improve detection of clinically relevant microorganisms.” (臨床尿培養:強化された技術による臨床関連微生物の検出の改善)。 ジャーナル・オブ・クリニカル・マイクロバイオロジー 54, no. 5 (2016): 1216-1222.
21. Sathiananthamoorthy, Sanchutha, James Malone-Lee, Kiren Gill, Anna Tymon, Trang K. Nguyen, Shradha Gurung, Linda Collins et al. “Reassessment of routine midstream culture in diagnosis of urinary tract infection” (尿路感染症の診断におけるルーチン尿培養の再評価). ジャーナル・オブ・クリニカル・マイクロバイオロジー 57, no. 3 (2019): e01452-18.
22. Cai, Tommaso, Sandra Mazzoli, Nicola Mondaini, Francesca Meacci, Gabriella Nesi, Carolina D’Elia, Gianni Malossini, Vieri Boddi, and Riccardo Bartoletti. “尿路感染症を再発する若い女性における無症候性細菌尿の役割:治療するかしないか?”. 臨床感染症 55, no.6 (2012): 771-777.
23. Lehmann, Lutz E., Stefan Hauser, Thomas Malinka, Sven Klaschik, Stefan U. Weber, Jens-Christian Schewe, Frank Stüber, and Malte Book. “SeptiFast® リアルタイムPCRによる迅速な定性的尿路感染症病原体の同定”. PLoS One 6, no.2 (2011).
24. Schmidt, K., K. K. Stanley, R. Hale, L. Smith, J. Wain, J. O’grady, and D. M. Livermore. “臨床尿中の腸内細菌科細菌の耐性遺伝子検出のためのマルチプレックスタンデムPCR(MT-PCR)アッセイの評価”. Journal of Antimicrobial Chemotherapy 74, no.2 (2019): 349-356.
25. Barczak, Amy K., James E. Gomez, Benjamin B. Kaufmann, Ella R. Hinson, Lisa Cosimi, Mark L. Borowsky, Andrew B. Onderdonk et al. “RNA signatures allow rapid identification of pathogens and antibiotic susceptibility.”. Proceedings of the national academy of sciences 109, no. 16 (2012): 6217-6222.
26. Urine-IDTM – Vikor Scientific. https://www.vikorscientific.com/test-menu/urine-id/. 2020年2月15日アクセス。
27. UTI尿キット – 保険|マイクロジェン・ダイアグノスティックス. https://microgendx.com/product/urine-kit-ins/. 2020年2月15日にアクセス。
28. ガイダンス – パスノスティックス. https://www.pathnostics.com/physicians/tests/guidance/. 2020年2月15日アクセス。
29. Gadalla, Amal AH, Ida M. Friberg, Ann Kift-Morgan, Jingjing Zhang, Matthias Eberl, Nicholas Topley, Ian Weeks et al. “Identification of clinical and urine biomarkers for uncomplicated urinary tract infection using machine learning algorithms.”. Scientific Reports 9, no.1 (2019): 1-11.
30. Burton, Ross J., Mahableshwar Albur, Matthias Eberl, and Simone M. Cuff.(バートン、ロス・J、マハブレシュワー・アルバー、マティアス・エベール、シモーネ・M・カフ)。 “尿路感染症の検出を損なうことなく診断の作業量を減らすための人工知能の使用”. BMC medical informatics and decision making 19, no.1 (2019): 171.
31. Bonkat, G., R. Pickard, R. Bartoletti, F. Bruyere, S. E. Geerlings, and F. Wagenlehner. 「泌尿器科感染症に関するガイドライン。 EAUガイドライン”. ヨーロッパ泌尿器科学会(2017).
32. Jhang, Jia-Fong, and Hann-Chorng Kuo. “再発性尿路感染症の最近の進歩 病態とバイオマーカーから予防まで”. 慈済医学雑誌 29, no. 3 (2017): 131.
33. Dason, Shawn, Jeyapandy T. Dason, and Anil Kapoor. “女性における再発性尿路感染症の診断と管理のためのガイドライン”. カナダ泌尿器科学会誌 5, no. 5 (2011): 316.
34. Karlsen, H., and T. Dong. “尿路感染症のバイオマーカー:技術の現状と、迅速なストリップベースの化学センサーの有望なアプリケーション”. Analytical Methods 7, no.19 (2015): 7961-7975.
35. 水谷浩介、川上恭司郎、堀江健吾、藤田泰典、亀山浩二、加藤拓、中根圭太ら. “Urinary exosome as a potential biomarker for urinary tract infection.”. Cellular microbiology 21, no.7 (2019): e13020.
関連コンテンツ:
Download: エブリデイ・ウロロジー 第5巻第1号