Lymeziekte
Overzicht
Het eerste geval van anaplasmose bij de mens werd beschreven in 1990, toen een patiënt uit Wisconsin een ernstige koortsachtige ziekte ontwikkelde na een tekenbeet en twee weken later overleed. Bloeduitstrijkjes toonden clusters van bacteriën aan in de neutrofielen van de patiënt, vergelijkbaar met de morulae die gezien worden in monocyten met E. chaffeensis infectie. Kweken en serologische tests voor E. chaffeensis waren echter negatief. Desondanks suggereerde het klinische beloop van de patiënt een vorm van ehrlichiose, en toen in de daaropvolgende jaren verschillende nieuwe gevallen van de ziekte werden gemeld in het noordelijke Midwesten, werd gesteld dat er mogelijk een nieuwe soort Ehrlichia in opkomst was. De nieuwe ziekte kreeg voorlopig de naam “humane granulocytaire ehrlichiose”, of HGE.
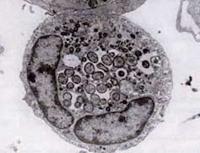
In 1994 bleek uit DNA-sequencing-onderzoek dat het HGE-agens duidelijk verschilde van E. chaffeensis, maar in wezen identiek was aan twee eerder bekende ehrlichiale veterinaire ziekteverwekkers, E. equi en E. (Cytoecetes) phagocytophila. In het kader van een nieuw taxonomisch schema dat sindsdien is ingevoerd, zijn deze drie organismen verenigd als één enkele soort binnen een nieuw genus, Anaplasma. De nieuwe soort wordt Anaplasma phagocytophilum genoemd, en de ziekte die zij veroorzaakt staat nu bekend als humane granulocytische anaplasmose, of HGA.
Zoals Ehrlichia-soorten zijn Anaplasma-organismen klein, gramnegatief, en intracellulair. A. phagocytophilum richt zich op neutrofielen, verandert hun functie in de gastheer, en vormt morulae in vacuolen. De meeste schade die A. phagocytophilum veroorzaakt, lijkt verband te houden met ontstekingsprocessen in de gastheer, aangezien er weinig aanwijzingen zijn voor een correlatie tussen het aantal organismen en de ernst van de ziekte.
Anaplasmose is een wereldwijde infectie, die voorkomt in Noord-Amerika, het grootste deel van Europa, en Oost-Azië. Teken van het Ixodes persulcatus-complex zijn de vectoren: I. scapularis in het noordoosten en het noordwesten van de Verenigde Staten; I. pacificus in het noordwesten van de Stille Oceaan; I. ricinus in Europa; en I. persulcatus in Azië. A. phagocytophilum wordt in de natuur in stand gehouden door de cycli tussen deze teken en verschillende kleine zoogdieren, voornamelijk muizen en andere kleine knaagdieren. Omdat Ixodes teken ook de vectoren zijn voor de ziekte van Lyme, babesiose en door teken overgedragen encefalitis, kan Anaplasma co-infectie met deze andere ziekten bij de mens voorkomen en gebeurt dit ook.
In de Verenigde Staten is het aantal gevallen van HGA groter dan dat van humane monocytaire ehrlichiose (HME) Net als bij HME en humane ewingii ehrlichiose is de mediane leeftijd van patiënten met HGA ongeveer 50 jaar.
Tekenen en symptomen
Het klinische beloop van HGA varieert van een asymptomatische infectie tot een fatale ziekte. De eerste symptomen, die ongeveer vijf tot tien dagen na de tekenbeet optreden, zijn grotendeels aspecifiek: koorts, koude rillingen, ernstige hoofdpijn en spierpijn; misselijkheid, hoest en gewrichtsontsteking kunnen ook voorkomen.
Vergeleken met HME lijkt HGA minder vaak het centrale zenuwstelsel te betreffen, maar perifere neuropathieën (b.v. gevoelloosheid en tintelingen) komen vaker voor en kunnen weken tot maanden aanhouden. In de medische literatuur wordt melding gemaakt van neurologische bevindingen zoals gezichtsverlamming, demyeliniserende polyneuropathie en brachiale plexopathie. Ademhalingsnoodsyndroom en een septisch of toxisch shock-achtig syndroom zijn gemeld, maar lijken minder vaak voor te komen dan bij HME. Het totale sterftecijfer als gevolg van HGA is zeer laag (minder dan 1%), waarbij de meeste sterfgevallen het gevolg zijn van opportunistische infecties (bijvoorbeeld herpes simplex oesofagitis, Candida pneumonitis, en pulmonale aspergillose) bij immuungecompromitteerde patiënten.
Diagnose
Standaard bloedonderzoek bij HGA laat meestal vergelijkbare bevindingen zien als bij HME: leukopenie, trombocytopenie, en leverfunctiestoornissen (verhoogde transaminasen). De hematologische afwijkingen verdwijnen echter vaak in de tweede week van de symptomen, zodat hun afwezigheid in die context moet worden geïnterpreteerd als de patiënten zich later in het verloop van hun ziekte presenteren. In het algemeen moet een empirische antibiotische behandeling worden overwogen voor patiënten in endemische gebieden die zich presenteren met een acute koortsachtige ziekte die op HGA wijst.
Voor een specifieke diagnose hebben met Wright of Giemsa gekleurde bloeduitstrijkjes een iets hogere opbrengst dan met HME, maar ze zijn nog steeds niet optimaal voor algemeen klinisch gebruik, aangezien er een grote variatie (25-75%) lijkt te zijn in de gevoeligheid van deze tests voor het zichtbaar maken van morulae in neutrofielen van de gastheer. Meer nuttig, maar niet altijd beschikbaar, zijn polymerase kettingreactie (PCR)-testen, waarvan de gevoeligheid op 67-90% wordt geschat. Voorafgaande antibiotische therapie vermindert de gevoeligheid van beide diagnostische methoden drastisch.
Serologisch onderzoek is nuttig om de diagnose van anaplasmose te bevestigen. De meest gebruikte methode is indirecte immunofluorescentie (IFA) van IgM en IgG anti-A. phagocytophilum antilichamen. Seroconversie is wellicht het gevoeligste laboratoriumbewijs van A. phagocytophilum-infectie, maar wordt niet altijd tijdig genoeg verkregen om nuttige input te leveren voor klinische (d.w.z. behandelings)beslissingen.