19.1: Polypeptides and Proteins
Learning Objectives
- Define or describe the following:
- amino acid
- ”R” group
- peptide bond
- peptide
- polypeptide
- primary protein structure
- secondary protein structure
- tertiary protein structure
- quaternary protein structure
- gene
- Describe how the primary structure of a protein or polypeptide ultimately detemines its final three-dimensional shape.
- Describe how the order of nucleotide bases in DNA ultimately determines the final three-dimensional shape of a protein or polypeptide.
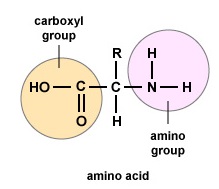
Amino acids are the building blocks for proteins. All amino acids contain an amino or NH2 group and a carboxyl (acid) or COOH group. There are 20 different amino acids commonly found in proteins and often 300 or more amino acids per protein molecule. Varje aminosyra skiljer sig åt genom sin R-grupp. R-gruppen i en aminosyra är resten av molekylen, dvs. den del som inte utgörs av aminogruppen, syragruppen och det centrala kolet. Alla olika aminosyror har en unik R-grupp och de unika kemiska egenskaperna hos en aminosyra beror på dess R-grupp (figur \(\PageIndex{1}\)).
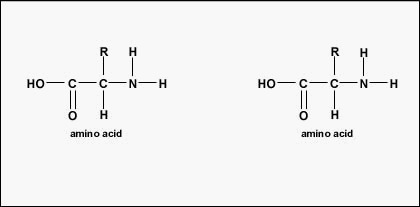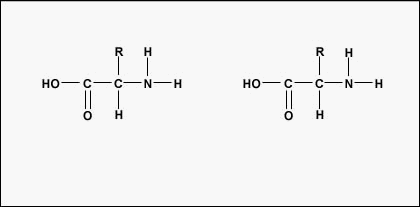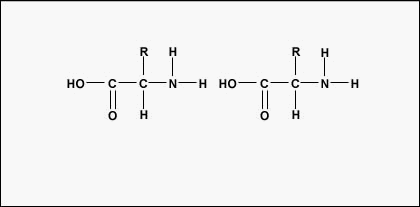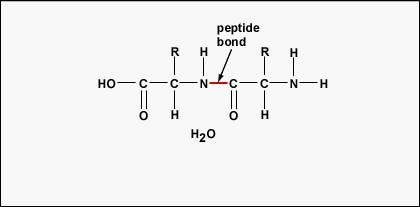
För att bilda polypeptider och proteiner är aminosyror sammanfogade genom peptidbindningar, där aminot eller NH2 i en aminosyra binder sig till en annan aminosyras karboxyl- (syra-) eller COOH-grupp, vilket framgår av (Figur \(\PageIndex{2}\) och Figur \(\PageIndex{3}\)).
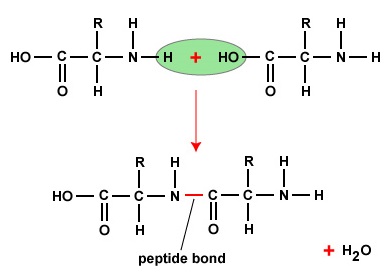
En peptid är två eller flera aminosyror som är sammanfogade med peptidbindningar, och en polypeptid är en kedja av många aminosyror. Ett protein innehåller en eller flera polypeptider. Därför är proteiner långa kedjor av aminosyror som hålls samman av peptidbindningar.
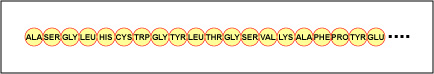
Den faktiska ordningen av aminosyrorna i proteinet kallas för dess primära struktur (Figur \(\(\PageIndex{4}\)) och bestäms av DNA. Som vi kommer att se senare i den här enheten är DNA uppdelat i funktionella enheter som kallas gener. En gen är en sekvens av desoxyribonukleotidbaser längs en DNA-sträng som kodar för en funktionell produkt – en specifik molekyl av budbärar-RNA, transfer-RNA eller ribosomalt RNA. Produkten är vanligtvis messenger RNA (mRNA) och mRNA resulterar i slutändan i syntesen av en polypeptid eller ett protein. Därför brukar man säga att ordningen på desoxyribonukleotidbaserna i en gen bestämmer aminosyrasekvensen för ett visst protein. Eftersom vissa aminosyror kan interagera med andra aminosyror i samma protein bestämmer denna primära struktur i slutändan den slutliga formen och därmed proteinets kemiska och fysiska egenskaper.
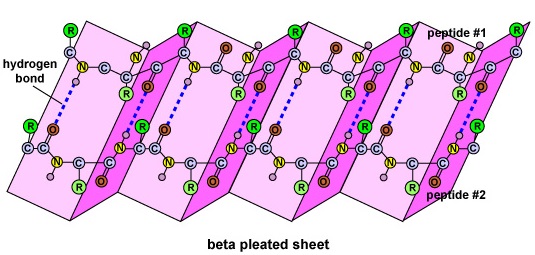
Proteinets sekundära struktur beror på vätebindningar som bildas mellan syreatomen i en aminosyra och kväveatomen i en annan. Detta ger proteinet eller polypeptiden den tvådimensionella formen av en alfa-helix eller ett beta-plisserat ark (figur \(\PageIndex{5}\)).
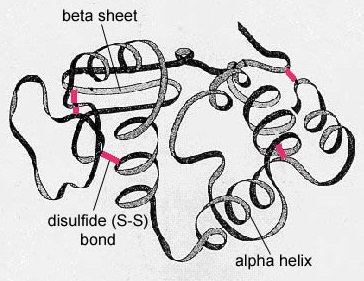
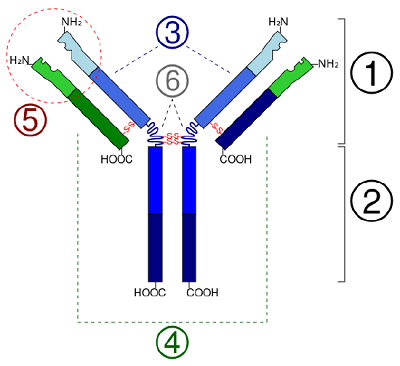
I globulära proteiner, t.ex. enzymer, blir den långa kedjan av aminosyror veckad till en tredimensionell funktionell form eller tertiärstruktur. Detta beror på att vissa aminosyror med sulfhydryl- eller SH-grupper bildar disulfidbindningar (S-S) med andra aminosyror i samma kedja. Andra interaktioner mellan aminosyrornas R-grupper, t.ex. vätebindningar, jonbindningar, kovalenta bindningar och hydrofoba interaktioner, bidrar också till den tertiära strukturen (figur \(\PageIndex{6}\)). I vissa proteiner, t.ex. antikroppsmolekyler och hemoglobin, kan flera polypeptider binda samman och bilda en kvartär struktur (figur \(\PageIndex{7}\)).
Som vi kommer att se längre fram i denna enhet, transkriberas under proteinsyntesen ordningen på nukleotidbaserna längs en gen till en komplementär sträng av mRNA, som sedan översätts av tRNA till den korrekta ordningen på aminosyrorna för den polypeptiden eller proteinet. Därför bestämmer ordningen på desoxyribonukleotidbaserna längs DNA:t ordningen på aminosyrorna i proteinerna. Eftersom vissa aminosyror kan interagera med andra aminosyror bestämmer ordningen av aminosyror för varje protein dess slutliga tredimensionella form, som i sin tur bestämmer proteinets funktion (t.ex, vilket substrat ett enzym kommer att reagera med, vilka epitoper en antikropps Fab kommer att kombinera med, vilka receptorer ett cytokin kommer att binda till).
Sammanfattning
- Aminosyror är byggstenar för proteiner. Det finns 20 olika aminosyror som vanligen förekommer i proteiner och ofta 300 eller fler aminosyror per proteinmolekyl.
- Alla aminosyror innehåller en amino- eller NH2-grupp och en karboxyl- (syra) eller COOH-grupp.
- För att bilda polypeptider och proteiner förenas aminosyror med varandra genom peptidbindningar, där aminosyrans amino- eller NH2-grupp i en aminosyra förenas med en annan aminosyras karboxyl- (syra)- eller COOH-grupp.
- En peptid är två eller flera aminosyror som förenas med varandra genom peptidbindningar, en polypeptid är en kedja av många aminosyror och ett protein innehåller en eller flera polypeptider. Därför är proteiner långa kedjor av aminosyror som hålls samman av peptidbindningar.
- Den faktiska ordningen på aminosyrorna i proteinet kallas dess primära struktur och bestäms av DNA.
- Den ordning som desoxyribonukleotidbaserna i en gen bestämmer aminosyrasekvensen för ett visst protein. Eftersom vissa aminosyror kan interagera med andra aminosyror i samma protein bestämmer denna primärstruktur i slutändan proteinets slutliga form och därmed dess kemiska och fysiska egenskaper.
- Proteinets sekundärstruktur beror på vätebindningar som bildas mellan syreatomen i en aminosyra och kväveatomen i en annan aminosyra och ger proteinet eller polypeptiden den tvådimensionella formen av en alfahelix eller ett beta-plisserat ark.
- I klotformiga proteiner, t.ex. enzymer, veckas den långa aminosyrakedjan till en tredimensionell funktionell form eller tertiärstruktur. Detta beror på att vissa aminosyror med sulfhydryl- eller SH-grupper bildar disulfidbindningar (S-S) med andra aminosyror i samma kedja. Andra interaktioner mellan aminosyrornas R-grupper, t.ex. vätebindningar, jonbindningar, kovalenta bindningar och hydrofoba interaktioner, bidrar också till den tertiära strukturen.
- In some proteins, such as antibody molecules, several polypeptides may bond together to form a quaternary structure.
Contributors and Attributions
-
Dr. Gary Kaiser (COMMUNITY COLLEGE OF BALTIMORE COUNTY, CATONSVILLE CAMPUS)