4. Starka och svaga baser
Svaga baser
Ammoniak är en typisk svag bas. Ammoniak i sig själv innehåller naturligtvis inga hydroxidjoner, men den reagerar med vatten för att producera ammoniumjoner och hydroxidjoner.
\
Däremot är reaktionen reversibel, och vid varje tidpunkt finns ungefär 99 % av ammoniaken fortfarande kvar i form av ammoniakmolekyler. Endast cirka 1 % har faktiskt producerat hydroxidjoner. En svag bas är en bas som inte helt omvandlas till hydroxidjoner i lösning. När en svag bas reagerar med vatten varierar jämviktsläget från bas till bas. Ju längre till vänster den är, desto svagare är basen.
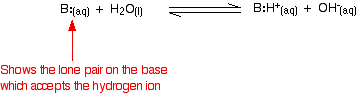
Du kan få ett mått på jämviktsläget genom att skriva en jämviktskonstant för reaktionen. Ju lägre värde för konstanten, desto mer ligger jämvikten till vänster. I det här fallet kallas jämviktskonstanten för Kb. Den definieras som:
\}{}\]
The relationship between Kb and pKb is exactly the same as all the other ”p” terms in this topic:
\
The table shows some values for \(K_b\) and \(pK_b\) for some weak bases.
| base | Kb (mol dm-3) | pKb |
|---|---|---|
| C6H5NH2 | 4.17 x 10-10 | 9.38 |
| NH3 | 1.78 x 10-5 | 4.75 |
| CH3NH2 | 4.37 x 10-4 | 3.36 |
| CH3CH2NH2 | 5.37 x 10-4 | 3.27 |