Adipocyter
Adipocyter är de viktigaste energilagringsplatserna i kroppen och har också viktiga endokrina funktioner. Därför är det viktigt att förstå adipocyternas utveckling och funktion – särskilt mot bakgrund av fetmaepidemin – för att förstå den metabola homeostasen. Det finns två allmänna klasser av adipocyter: vita adipocyter – som lagrar energi i form av en enda stor lipiddroppe och har viktiga endokrina funktioner, och bruna adipocyter – som lagrar energi i flera små lipiddroppar, men specifikt för att användas som bränsle för att generera kroppsvärme (dvs. termogenes). Värmeproduktion av bruna adipocyter möjliggörs av deras unika uttryck av mitokondriellt lokaliserat frikopplingsprotein 1 (Ucp1). Dessa klassificeringar är dock alltför förenklade eftersom vissa vita adipocyter kan anta egenskaper hos bruna adipocyter (benämnda brite eller beige adipocyter) och vice versa beroende på temperatur och kost. Vi är intresserade av att förstå ursprunget till olika adipocyter och att definiera de signal- och metaboliska vägar som styr deras utveckling, distribution och funktion.
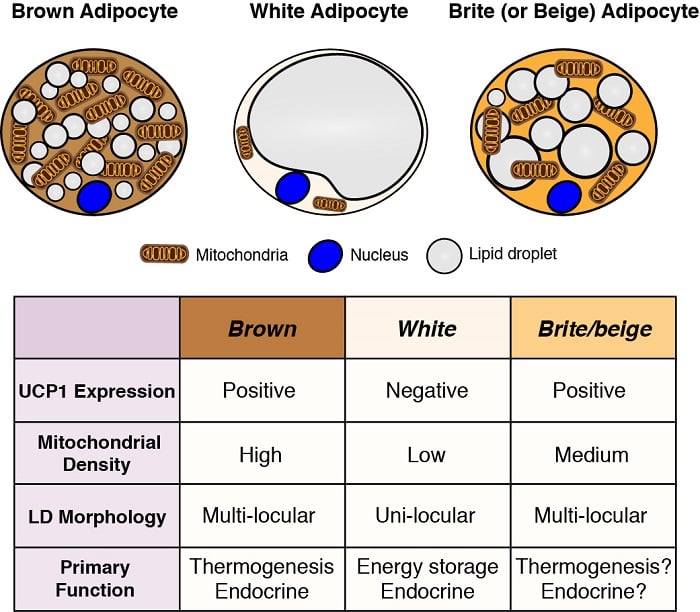
Adipocyternas ursprung
En central del av förståelsen av fettvävnadens roll för hälsa och sjukdom är att förstå hur den växer, och i det avseendet är ett av de minst förstådda områdena inom fettvävnadsbiologin det utvecklingsmässiga ursprunget för olika typer av adipocyter. Att definiera adipocyternas ursprung skulle kunna bidra till att förklara fördelningsmönster för kroppsfett hos människor, särskilt hos överviktiga eller lipodystrofa individer, och det kan ge ledtrådar till metaboliska skillnader som observerats mellan vissa fettdepåer. Att identifiera adipocytprekursorceller och de mekanismer som reglerar deras expansion är också avgörande för att förstå och hantera en sund fettvävnadsfunktion. Det kan också vara möjligt att skapa utveckling av ”friska” adipocyter (t.ex. bruna eller bruna/beige adipocyter) från prekursorer för cellbaserade terapier som i huvudsak syftar till att bekämpa fett med fett. Med hjälp av en kombination av genetik och strategier för spårning av linjer har vi tidigare kartlagt ursprunget till adipocyter som finns i olika depåer. Våra resultat avslöjar en oväntad nivå av heterogenitet som är förenlig med att adipocyter har flera olika utvecklingsursprung och som stöder en modell där adipocytens öde sannolikt beror på både extrinsiska och intrinsiska faktorer.
Adipocyter har flera olika utvecklingsursprung
(nedan till vänster) Anatomisk fördelning av depåer av fettvävnad i en mus. Bruna fettvävnader (BAT) och vita fettvävnader (WAT) visas. (nedan till höger) Ett exempel på ett experiment för spårning av linjer under vilket utvecklingsförberedande celler och alla deras avkommor märktes på ett outplånligt sätt med ett fluorescerande märke kopplat till uttryck av Myf5 (panel a) eller Pax3 (panel b). Adipocyter märkta i grönt (mGFP) kommer från en annan prekursorcell än de adipocyter som är märkta i rött (mTFP).
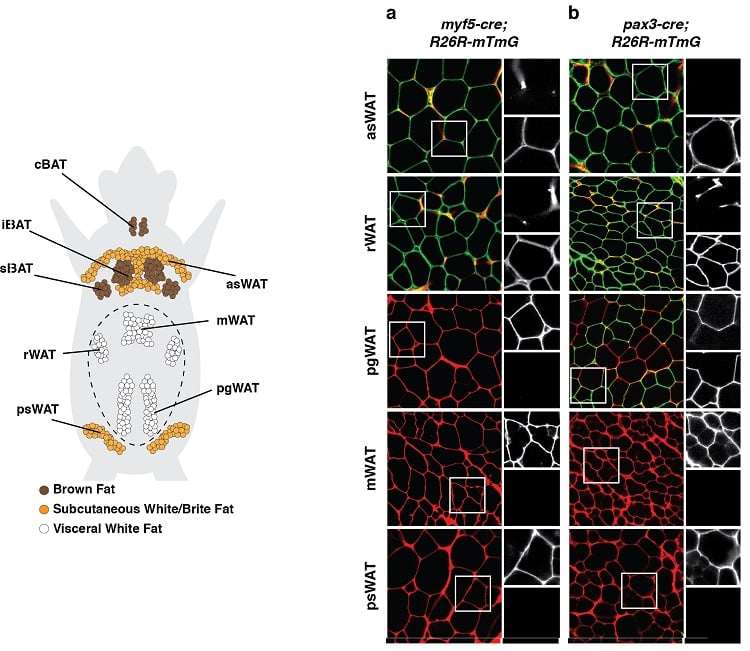
Resultat som dessa tyder på att adipocyter har flera olika utvecklingsursprung.
(anpassad från Sanchez-Gurmaches & Guertin, Nature Communications 2014; Sanchez-Gurmaches et al., Trends in Cell Biology 2016).
Bruna adipocyter
Bruna adipocyter är fascinerande celler. De finns bara hos däggdjur, och deras huvudfunktion är att generera endogen värme i en process som kallas termogenes. Detta möjliggörs av deras unika uttryck av ett mitokondriellt membranprotein som kallas för uncoupling protein 1 (UCP1). Det bruna fettets energiåtgående egenskaper, och den senaste insikten om att vuxna människor har brunt fett, har gjort dem till ett mål för terapier som syftar till att bekämpa övernäring. Aktiva bruna adipocyter har också ett av de mest spännande metaboliska programmen: de tar upp och konsumerar stora mängder av olika näringsämnen samtidigt (t.ex. glukos, lipider, aminosyror) och kan samtidigt engagera sig i både anabol och katabol metabolism. Vi och andra har till exempel tidigare visat att kallstimulerad BAT i stor utsträckning uppreglerar ett genetiskt program som stöder de novo lipidsyntesvägar utöver fettsyraoxidationsvägarna . Vi skulle vilja förstå mer om denna anmärkningsvärda och paradoxala metabolism.
Lär dig mer om brun fettvävnads utveckling och ämnesomsättning
Anatomisk placering av brunt fett hos människor
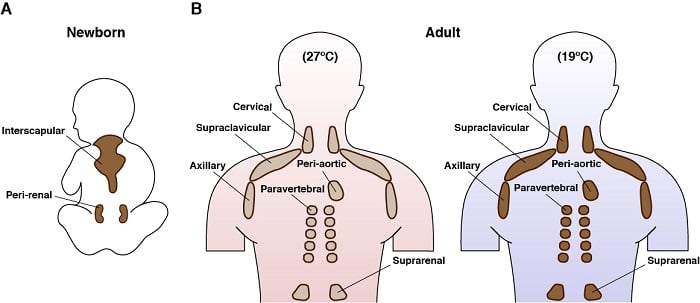
Vi använder också genetiska modeller för att undersöka hur signalvägar styr BAT-metabolismen. Med hjälp av möss har vi till exempel genetiskt raderat Rictor – som kodar för en unik och viktig komponent i mTORC2 – endast i brun fettvävnad. Läs mer om mTORC2. Anmärkningsvärt nog är dessa möss skyddade från en fettrik kost. Mer specifikt ackumulerade möss som saknade BAT Rictor inte överdrivna lipider i levern eller i den viscerala fettvävnaden när de åt en fettrik kost . Detta är ett spännande resultat eftersom överdriven lipidlagring i dessa områden är farligt ohälsosamt. Med hjälp av en kombination av genetik, genomik, metabolomik och biokemi försöker vi förstå varför dessa möss är skyddade från fettrik kost.
Vita adipocyter
Vita adipocyter är de mest förekommande adipocyterna hos människor. Depåer av vit fettvävnad har också en anmärkningsvärd förmåga att expandera och lagra energi, och de signalerar till hjärnan och andra vävnader för att starkt påverka ätbeteende och metabolisk homeostas. Även om vita adipocyter är specifikt anpassade för att på ett säkert sätt låsa in överskottsnäring har de dock en brytpunkt (t.ex. vid fetma) där deras gynnsamma funktioner misslyckas, och detta främjar starkt uppkomsten av metabola sjukdomar och typ 2-diabetes. Vad definierar tipping point? Hur signalerar vita adipocyter till andra vävnader? Hur heterogena är depåerna av vit fettvävnad? Varför är ett överskott av visceralt fett mer skadligt för hälsan än ett överskott av subkutant fett? Detta är alla frågor som vi är intresserade av.
Vi studerar också mTOR-signalering i vita adipocyter. mTOR är ett viktigt nedströmsmål för insulinsignalering, som är det viktigaste hormonet som adipocyter reagerar på. Med hjälp av genetiska musmodeller har vi selektivt inhiberat antingen mTORC1 eller mTORC2 i alla adipocyter. Hämning av mTORC1 i vit fettvävnad orsakar ett lipodystrofi-liknande syndrom som är förknippat med insulinresistens och fettleversjukdom. Hämning av mTORC2 i vit fettvävnad orsakar också insulinresistens, men oberoende av förändringar i fettvävnadsmassan. I den sistnämnda modellen verkar mTORC2 reglera en signal från adipocyter som kommunicerar med levern för att kontrollera hepatisk glukosproduktion. Att förstå den mekanistiska grunden för dessa fenotyper kommer att ge viktig information om hur näringssänkande signaltransduktionsvägar bidrar till patogenesen för fettvävnadsrelaterade sjukdomar.
Modell för mTORC2-signalering i en vit adipocyt
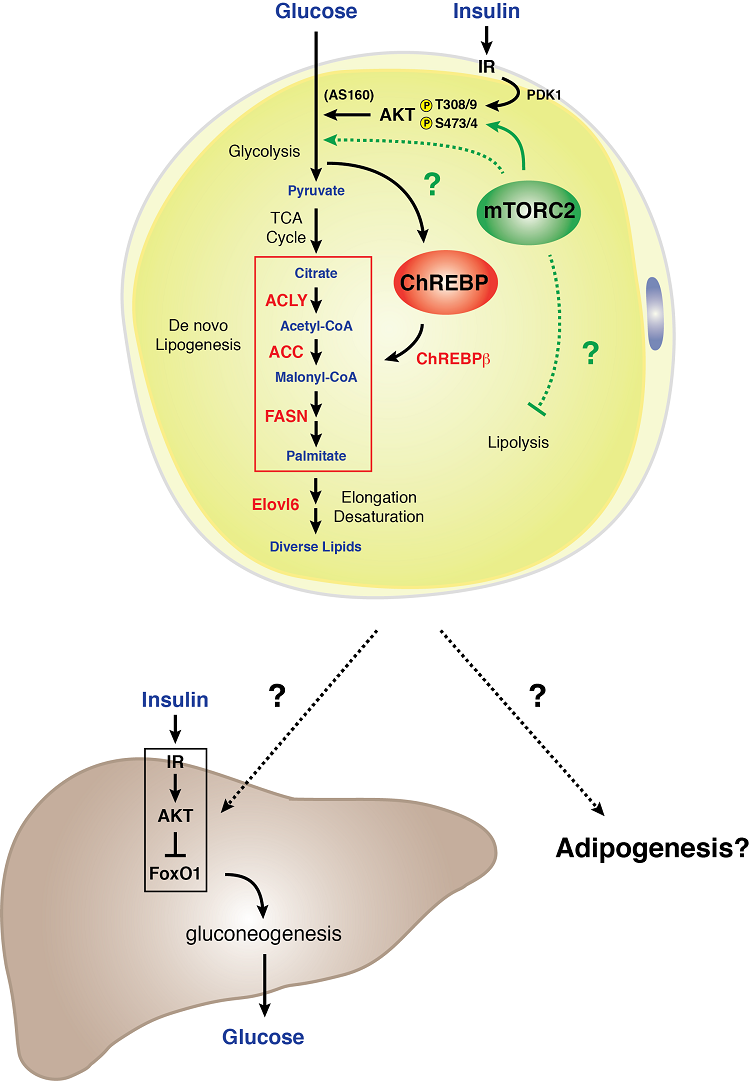 Vita adipocyter kräver mTORC2 för en normal kolhydrat- och lipidmetabolism. Vi fann att genetisk förlust av Rictor (mTORC2) specifikt i vita adipocyter minskar glukosupptaget och dämpar uttrycket av transkriptionsfaktorn ChREBP-beta och dess nedströmsmål – vilket inkluderar de enzymer som fungerar i de novo lipogenesvägen. Dessutom leder en mTORC2-brist i vita fettceller till allvarlig hepatisk insulinresistens. Dessa data tyder på att mTORC2 i vita adipocyter är en viktig regulator av kolhydrat- och lipidmetabolismen och är en nyckelkomponent i en extrahepatisk organkommunikationsmekanism som känner av näringsämnen och som kontrollerar den systemiska glukoshomeostasen . Att förstå biologin bakom mTORC2-signalering i vitt fett kan ge viktiga ledtrådar till hur vit fettvävnad fungerar som ett glukosavkännande organ och förmedlare av systemisk metabolisk fitness.
Vita adipocyter kräver mTORC2 för en normal kolhydrat- och lipidmetabolism. Vi fann att genetisk förlust av Rictor (mTORC2) specifikt i vita adipocyter minskar glukosupptaget och dämpar uttrycket av transkriptionsfaktorn ChREBP-beta och dess nedströmsmål – vilket inkluderar de enzymer som fungerar i de novo lipogenesvägen. Dessutom leder en mTORC2-brist i vita fettceller till allvarlig hepatisk insulinresistens. Dessa data tyder på att mTORC2 i vita adipocyter är en viktig regulator av kolhydrat- och lipidmetabolismen och är en nyckelkomponent i en extrahepatisk organkommunikationsmekanism som känner av näringsämnen och som kontrollerar den systemiska glukoshomeostasen . Att förstå biologin bakom mTORC2-signalering i vitt fett kan ge viktiga ledtrådar till hur vit fettvävnad fungerar som ett glukosavkännande organ och förmedlare av systemisk metabolisk fitness.