Ansättning av geovetenskap för Australiens viktigaste utmaningar
Introduktion

Aluminiumfolie. Källa: Wikimedia Commons
Aluminium finns överallt omkring dig – från vardagliga föremål som en läskedrycksburk till flygplan som flyger över oss. Aluminium är ett av de mest användbara material som människan känner till. Det kan legeras (blandas) med nästan vilken annan metall som helst för att skapa material med användbara egenskaper. Metaller som legerats med aluminium är alla mycket starka men ändå lätta och motståndskraftiga mot rost.
Efter syre och kisel är aluminium det tredje vanligaste grundämnet i jordskorpan (8,2 %) och den i särklass mest rikliga metallen. Till skillnad från metaller som koppar, guld, bly, järn och zink, som har använts av människor i tusentals år, har aluminium endast varit i allmänt bruk i drygt 100 år. Detta beror på att aluminium aldrig förekommer i rent tillstånd i naturen. Även om människan kände till aluminiumföreningar upptäckte hon inte hur man utvinner aluminiummetall förrän i slutet av 1800-talet.
Aluminium kan utvinnas (på ett oekonomiskt sätt) ur vissa leror, men den vanligaste aluminiummalmen är ett material som kallas bauxit. Först måste aluminiummalmen brytas, sedan raffineras bauxiten till aluminiumoxid (aluminiumoxid). Stora mängder elektricitet används för att smälta aluminiumoxid till aluminiummetall.
Egenskaper
Aluminium är en silverfärgad metall som aldrig förekommer ensam i naturen. Den är mycket lätt (ungefär en tredjedel av kopparens vikt) men ändå stark; vissa legeringar är till och med starkare än stål. Aluminium är både formbart (kan pressas i form) och duktilt (kan slås och dras till en tråd). Aluminium är en mycket god värmeledare och elektrisk ledare. Det är också mycket rostbeständigt och är giftfritt. Aluminium kan legeras med nästan vilken annan metall som helst. Aluminium är brännbart, icke-magnetiskt och gnistfritt. These properties have made it an important metal in the modern world. As aluminium is such a reactive metal, you might think it would rust badly and therefore be useless. However, pure aluminium reacts very quickly with air or water to form a thin, almost invisible layer of aluminium oxide on its surface, which then acts as a protective coating preventing any further ’rusting’.
|
The Properties of Aluminium |
|
|---|---|
|
Chemical symbol |
Al – from the Roman word Alumen – the word for the aluminium-potassium compound alum |
|
Ore |
Bauxite |
|
Relative density |
2.7 g/cm3 |
|
Hardness |
2.75 on Mohs scale |
|
Malleability |
High |
|
Ductility |
High |
|
Melting point |
660°C |
|
Boiling Point |
2470°C |
Uses

Aluminium-bodied Austin ”A40 Sports” (c. 1951). Källa: Wikimedia Commons
Aluminium is smelted from alumina which is refined from bauxite ore. All three products have a number of uses.
More than 90% of the world’s bauxite production is used to make alumina with most of the remaining 10% used by the abrasive, refractory and chemical industries. Bauxite is also used in the production of high-alumina cement, as an absorbent or catalyst by the oil industry, in welding rod coatings and as a flux in making steel and ferroalloys.
Alumina’s primary use is as feedstock for aluminium smelters, however it is also used for other industrial purposes. It is used in glass, porcelain and in metallic paints, such as those sprayed on cars. Den används också vid tillverkning av tändstiftsisolatorer, som bränslekomponent i fasta raketboosters, som fyllmedel för plast, som slipmedel (den är billigare än industridiamant) och i metallraffinaderier där den används för att omvandla giftiga svavelväteavfallsgaser till elementärt svavel.
Alumina som förekommer i naturligt, kristallint tillstånd benämns som mineralet korund. Ibland är korundkristaller förorenade med spår av krom, järn, titan, koppar eller magnesium. Vi kallar dessa kristaller för rubiner och safirer.
Efter järn och stål är aluminium den mest använda metallen på jorden. Den legeras ofta med koppar, zink, magnesium, mangan eller kisel och tillsatsen av små mängder zirkonium, hafnium eller scandium till dessa legeringar förbättrar deras hållfasthet markant. Aluminium kan användas på många olika sätt, från specialiserad flygplanskonstruktion till vardagliga föremål som knivar och gafflar. Några av användningsområdena anges i tabellen nedan.
|
Use |
Description |
|---|---|
|
Building and construction |
Cladding, doors, window frames, awnings and bridge rails as aluminium is strong, light, easily shaped and resistant to rust. |
|
Transport |
Parts for cars, trucks, buses, aircraft, ships, rail and trams as aluminium is strong, light, easily shaped and resistant to rust. |
|
Appliances |
Fridges, washing machines, lawn mowers etc. due to its strength, malleability and rust resistance. |
|
Heating and ventilation |
Heating and cooling systems as aluminium is a good conductor of heat. |
|
Packaging |
Kitchen foil, packaging foil, cans and containers (worldwide, four out of every five drink cans are made of aluminium) as aluminium can be rolled into very thin sheets and is non-toxic. |
|
Electrical and communications |
Power transmission including towers, electrical conduits, superconductors, machinery and equipment, telephone cables and capacitors because of aluminium’s ability to conduct electricity. |
|
Other |
Utensils (cutlery, pans), industrial machinery, chemical industry, production of steel, antiperspirants, furniture, reflectors in telescopes, making high octane petrol, road signs, antacids and jewellery due to its many useful properties. |
History
Around 5300 BC: The Persians made extra strong pots from clay containing aluminium oxide.
Around 2000 BC: The ancient Egyptians and Babylonians used potassium aluminium sulphate KAl(SO4)2 as a medicine to reduce bleeding. It was sourced from naturally occurring deposits in Greece and Turkey. The ancient Romans called this medical compound ”alum”, which is where we get the modern day word and symbol from. Det används fortfarande idag för att stoppa blödningar.
Medeltiden: Det mesta alunet kom från det påvliga territoriet Tolfa, men priset sjönk dramatiskt när en stor fyndighet av alunskiffer upptäcktes i Yorkshire i början av 1600-talet. Under de följande århundradena användes alun på två huvudområden: som konserveringsmedel för papper och som fixeringsmedel för att färga tyg.
1808: Engelsmannen Sir Humphry Davy försökte utvinna aluminium genom elektrolys. Han misslyckades men konstaterade att aluminium fanns och gav det sitt namn.
1821: Den franske geologen Pierre Berthier upptäckte ett aluminiumrikt material nära byn Les Baux i Provence, Frankrike. Det fick namnet bauxit efter byn.
1825: Hans Christian Oersted i Danmark framställde orent aluminium genom att värma aluminiumklorid med kaliumamalgam.
1827: Den tyske kemisten Friedrich Wöhler utvann aluminium som ett pulver genom att låta kalium reagera med vattenfri aluminiumklorid och förbättrade därmed Oersteds process.
1855: Det är en av de viktigaste metoderna för att förbättra Oerstedprocessen. Aluminiumstången ansågs så värdefull att den samma år ställdes ut tillsammans med de franska kronjuvelerna.
1886: Två forskare på olika kontinenter (Charles Hall i Amerika och Paul Heroult i Frankrike) upptäckte oberoende av varandra en ekonomisk metod för att framställa aluminium genom elektrolys i smält kryolit (natriumaluminiumfluorid). Båda var för övrigt födda 1864 och båda dog 1914.
1887: Österrikiska kemisten Karl Josef Bayer som arbetade i Ryssland utvecklade en metod för att utvinna aluminiumoxid ur bauxit.
1888: Den österrikiska kemisten Karl Josef Bayer utvecklade en metod för att utvinna aluminiumoxid ur bauxit: Hall grundade Pittsburgh Reduction Company (känt som Alcoa sedan 1907).
1890: Det är en av de största utmaningarna för aluminium. År 1888 kostade aluminium 4,86 dollar per pund. År 1893 kostade det 0,78 US-dollar per pund och i slutet av 1930-talet kostade det bara 0,20 US-dollar per pund och hade mer än 2000 användningsområden.
1900: Bara 8000 ton aluminium producerades, men 100 år senare producerades 24,5 miljoner ton och 2016 beräknades 57,6 miljoner ton produceras.

F-16 stridsflygplanet utformades för att vara relativt billigt att bygga och enklare att underhålla än tidigare generationer av stridsflygplan. Skrovet är byggt av cirka 80 % aluminiumlegeringar av flygteknisk kvalitet, 8 % stål, 3 % kompositmaterial och 1,5 % titan. Källa: Wikimedia Commons, Master Sgt Andy Dunaway
1911: Den tyske kemisten Alfred Wilm utvecklade viktiga aluminiumlegeringar som var tillräckligt solida för att användas för tillverkning av t.ex. flygplan. Det fanns en stor efterfrågan på aluminium under andra världskriget och Koreakriget eftersom flygplan tidigare hade tillverkats av trä och tyg.
1922: Aluminiumfolie tillverkades.
1955: Det första aluminiumsmältverket i Australien öppnades i Bell Bay, Tasmanien.
1958: Det första aluminiumsmältverket i Australien öppnades i Bell Bay, Tasmanien: Aluminiumburkar för läskedrycker tillverkades för första gången.
1961: Alcoa bildar Alcoa of Australia.
1963: Alcoa bildar Alcoa of Australia: Alcoa of Australia öppnar det första aluminiumoxidraffinaderiet i Australien i Kwinana i västra Australien, följt av Pinjarra 1972 och Wagerup 1984.
I dag: År 2016 producerades uppskattningsvis 57,6 miljoner ton aluminium. Detta är mer än alla andra icke-järnmetaller tillsammans. Australien bryter bauxit i Queensland, Western Australia, Northern Territory och Tasmanien och är världens största bauxitproducent. Australien är också världsledande när det gäller produktion av aluminiumoxid och aluminium. De tre raffinaderierna i västra Australien levererar 45 procent av Australiens aluminiumoxid och 11 procent av den globala produktionen, vilket gör dem till den största enskilda källan till aluminiumoxid i världen.
Formation

Weipa bauxit, R30128. Källa: Bauxit- och bauxitfabriker (2016): Geoscience Australia.
Bauxit är den vanligaste aluminiummalmen. Bauxit förekommer som ett vädertäckt eller täcke, känt som laterit eller duricrust, över en mängd olika aluminiumhaltiga bergarter. Den bildas när stora regnmängder lakar bort de mer rörliga grundämnena i värdberget och lämnar kvar det relativt orörliga aluminiumet tillsammans med en del kisel, järn och titan. På grund av det sätt på vilket den bildas kan bauxitfyndigheter vara mycket omfattande och finns på nästan alla kontinenter.
De viktigaste aluminiummineralerna i bauxit är gibbsit , boehmit och diaspore, som är en polymorf (alternativ form) av boehmit men som är tätare och hårdare. Ren aluminiumoxid (Al2O3) innehåller 52,9 % aluminium och 47,1 % syre. Bauxit kan vara mycket hård eller mjuk som lera och kan förekomma som packad jord (både spröd och återcementerad), små kulor (pisoliter) eller ihåligt, kvistliknande material (tubuli). Färgen kan vara röd, rosa, gul, röd eller vit, eller en kombination av dessa. Aluminium finns också i många ädelstenar som turkos, rubiner, safirer, smaragder, topas, jade och akvamariner.
Källor
Bauxitmalm innehåller tillräckligt höga halter av aluminiumoxider och lämpligt låga halter av järnoxid (Fe2O3) och kiseldioxid (SiO2) för att vara ekonomiskt brytbar. Mängden reaktiv kiseldioxid är särskilt viktig eftersom denna form av kiseldioxid förbrukar den kaustiksoda som behövs för att framställa aluminiumoxid, varför en låg halt reaktiv kiseldioxid är önskvärd. Andra potentiella källor till aluminium är en rad olika bergarter och mineraler som t.ex. aluminiumskiffer och skiffer, aluminiumfosfatsten och leror med hög aluminiumhalt.
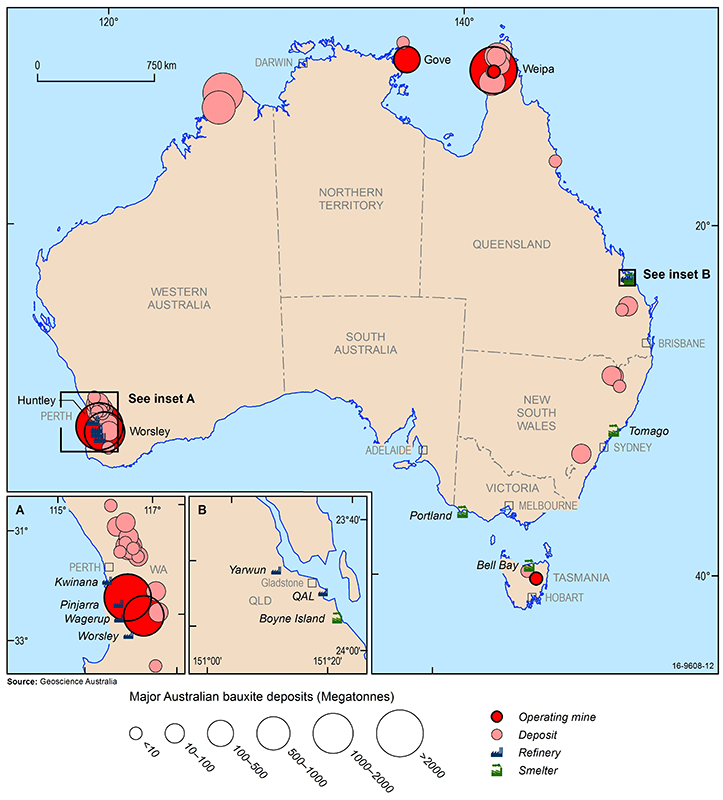
Australiens större bauxitfyndigheter, gruvor, aluminiumoxidraffinaderier och aluminiumsmältverk (2016). Source: Geoscience Australia.
Världens största ekonomiska bauxitresurser finns i Guinea, Australien, Brasilien, Vietnam och Jamaica. I Australien bryts bauxit från etablerade dagbrott i Weipa i Queensland, Gove i Northern Territory och Darling Range i Western Australia. Dessutom har nya gruvor nyligen inletts i Cape York-regionen i Queensland och i centrala Tasmanien. Andra bauxitfyndigheter finns i norra västra Australien, New South Wales och östra Queensland men är för närvarande oekonomiska att bryta.
Australiens aluminiumoxidraffinaderier finns i västra Australien (Kwinana, Wagerup, Pinjarra och Worsely) och Queensland (QAL och Yarwun) och dess aluminiumsmältverk finns i Tasmanien (Bell Bay), Queensland (Boyne Island), Victoria (Portland) och New South Wales (Tomago). Kina är världens största konsument av aluminium och importerar, trots en stark inhemsk produktion, stora mängder aluminiumoxid och rå bauxit, som står för mer än 40 % av den globala konsumtionen. Andra stora aluminiummarknader är Förenta staterna, Japan och Europa, men dessa regioner har få ekonomiska bauxitfyndigheter och är också beroende av import av bauxit och aluminiumoxid för sina aluminiumraffinaderier och aluminiumsmältverk.
Förlängre information om resurser och produktion.
Brytning
Utvinning av aluminiummetall sker i tre huvudsakliga steg¿brytning av bauxitmalm, raffinering av malmen för att utvinna aluminiumoxid och smältning av aluminiumoxid för att framställa aluminium. Bauxit bryts med hjälp av ytmetoder (dagbrottsbrytning) där matjord och överlagring avlägsnas med bulldozers och skrapor. Matjorden lagras sedan och används senare för att återplantera och återställa området efter avslutad brytning. Den underliggande bauxiten bryts med hjälp av frontlastare, maskinella skott eller hydrauliska grävmaskiner. Vissa bauxitmalmer krossas, torkas och transporteras. Annan bauxit behandlas efter krossning genom tvättning för att avlägsna en del av leran, den reaktiva kiseldioxiden och sandavfallet, och torkas sedan i roterugnar. Malmen lastas på lastbilar, järnvägsvagnar eller transportband och transporteras till fartyg eller raffinaderier.
Ett antal faktorer i aluminiumproduktionscykeln har med miljön att göra, och betydande resurser avsätts för att minimera gruvdriftens, raffineringens och smältningens inverkan på den omgivande miljön. Återställande av gruvor sker genom att man gör allt man kan för att återställa området till åtminstone dess ursprungliga skick. Försiktighet iakttas vid hantering och bortskaffande av rödslam från raffinaderierna. Leran pumpas vanligen in i dammar som förseglas med ogenomträngligt material för att förhindra förorening av det omgivande landskapet.
Bearbetning
I nästan alla kommersiella verksamheter utvinns aluminiumoxid från bauxiten genom Bayer-raffineringsprocessen. Processen, som upptäcktes av Karl Josef Bayer 1888, består av fyra steg:
Förbränning: Den finfördelade bauxiten matas in i en ånguppvärmd enhet som kallas kokare. Här blandas den under tryck med en varm lösning av kaustiksoda. Aluminiumoxiden i bauxiten (och den reaktiva kiseldioxiden) reagerar med kaustiksoda och bildar en lösning av natriumaluminat eller grönlut och en utfällning av natriumaluminiumsilikat.
Klargörning: Den gröna vätskan eller den aluminiumhaltiga lösningen avskiljs från avfallet¿ de olösta järnoxiderna och kiseldioxiderna som ingick i den ursprungliga bauxiten och som nu utgör sanden och det röda slammet i avfallet. Detta steg omfattar tre steg: för det första avlägsnas och tvättas det grova sandavfallet för att återvinna kaustiksoda, för det andra separeras rödslammet, och slutligen pumpas den återstående gröna vätskan genom filter för att avlägsna eventuella kvarvarande föroreningar. Sanden och slammet pumpas tillsammans till restsjöar och den gröna vätskan pumpas till värmeväxlare där den kyls från 1000 °C till cirka 650-790 °C.
Fällning: Aluminiumoxiden fälls ut från vätskan i form av kristaller av aluminiumhydrat. För att göra detta blandas den gröna vätskan i höga fällningskärl med små mängder finkristallin aluminiumoxid, vilket stimulerar utfällningen av fast aluminiumhydroxid när lösningen kyls ned. När det fasta aluminiumhydratet är färdigt går det vidare till nästa steg och den återstående vätskan, som innehåller kaustiksoda och en del aluminiumoxid, går tillbaka till rötkamrarna.
Kalcinering: Aluminiumhydratet tvättas för att avlägsna eventuell återstående vätskan och torkas sedan. Slutligen upphettas det till cirka 1000 °C för att driva bort kristalliseringsvattnet och lämna kvar aluminiumoxid – ett torrt, rent vitt, sandigt material. En del av aluminiumoxiden kan lämnas kvar i hydratform eller vidareförädlas för kemisk industri.
Alumina omvandlas till aluminium genom en smältningsprocess. All kommersiell produktion av aluminium bygger på Hall-Héroults smältningsprocess där aluminium och syre i aluminiumoxiden separeras genom elektrolys. Vid elektrolys leds en elektrisk ström genom en smält lösning av aluminiumoxid och naturlig eller syntetisk kryolit (natriumaluminiumfluorid). Den smälta lösningen finns i reduktionsceller eller krukor som i botten är försedda med kol (katod) och som är sammankopplade i en elektrisk serie, en s.k. potline. I toppen av varje kruka finns kolanoder, vars bottnar är nedsänkta i den smälta lösningen.
Den elektriska strömmen gör att syret från aluminiumoxiden förenas med kolet i anoden och bildar koldioxidgas. Det återstående smälta metalliska aluminiumet samlas vid katoden på botten av krukan. Med jämna mellanrum sugs den av och överförs till stora ugnar. Orenheter avlägsnas, legeringsämnen tillsätts och det smälta aluminiumet gjuts till göt.
Smältningsprocessen är en kontinuerlig process. Allteftersom aluminiumoxidinnehållet i kryolitbadet minskar tillsätts mer. Den värme som alstras av den elektriska strömmen håller kryolitbadet i smält tillstånd så att aluminiumoxiden löses upp. En stor mängd energi förbrukas under smältningsprocessen; 14 000-16 000 kilowattimmar elektrisk energi behövs för att producera ett ton aluminium från cirka två ton aluminiumoxid. Aluminium kallas ibland för ”fast elektricitet” på grund av den stora mängd energi som används vid tillverkningen. Tillgången till billig el är därför avgörande för en ekonomisk produktion.
Aluminiummängder tillverkas i olika former och storlekar beroende på slutanvändning. De kan valsas till plåt, ark, folie, stänger eller stänger. De kan dras till tråd som sedan strängas till kablar för elektriska överföringsledningar. Pressar extruderar göt till hundratals olika användbara och dekorativa former, och tillverkningsanläggningar kan omvandla dem till stora konstruktionsformer.