Biologiska principer
Efter att ha lärt sig att kemiska reaktioner frigör energi när energilagrande bindningar bryts, är en viktig nästa fråga följande: Hur kvantifieras och uttrycks den energi som är förknippad med dessa kemiska reaktioner? Hur kan den energi som frigörs vid en reaktion jämföras med den energi som frigörs vid en annan reaktion? En mätning av fri energi används för att kvantifiera dessa energiöverföringar. Kom ihåg att enligt termodynamikens andra lag innebär alla energiöverföringar att en viss energimängd går förlorad i en oanvändbar form, t.ex. i form av värme. Med fri energi avses specifikt den energi som är kopplad till en kemisk reaktion och som är tillgänglig efter att förlusterna har räknats bort. Med andra ord är fri energi användbar energi, eller energi som är tillgänglig för att utföra arbete. Om man ser på detta begrepp i en biologisk mening är fri energi den energi i en molekyl som kan användas för att utföra arbete. Glukos har mycket fri energi eftersom det finns mycket energi lagrad inom bindningarna i glukosmolekylen. Koldioxid har en mycket lägre fri energi eftersom det finns mycket mindre energi lagrad i dess bindningar.
Om energi frigörs under en kemisk reaktion kommer förändringen i fri energi från omvandlingen av reaktanterna till produkterna, betecknad som ΔG (delta G) att vara ett negativt tal. En negativ förändring av den fria energin innebär också att reaktionens produkter har mindre fri energi än reaktanterna, eftersom de frigör en del fri energi under reaktionen. Reaktioner som har en negativ förändring av den fria energin och följaktligen frigör fri energi kallas exergoniska reaktioner. Tänk: exergonisk innebär att energi lämnar systemet. Dessa reaktioner kallas också spontana reaktioner, och deras produkter har mindre lagrad energi än reaktanterna. En viktig distinktion måste göras mellan termen spontan och idén om att en kemisk reaktion inträffar omedelbart. I motsats till vad som sägs i dagligt tal är en spontan reaktion inte en reaktion som inträffar plötsligt eller snabbt. Att järn rostar är ett exempel på en spontan reaktion som sker långsamt, lite efter lite, över tid.
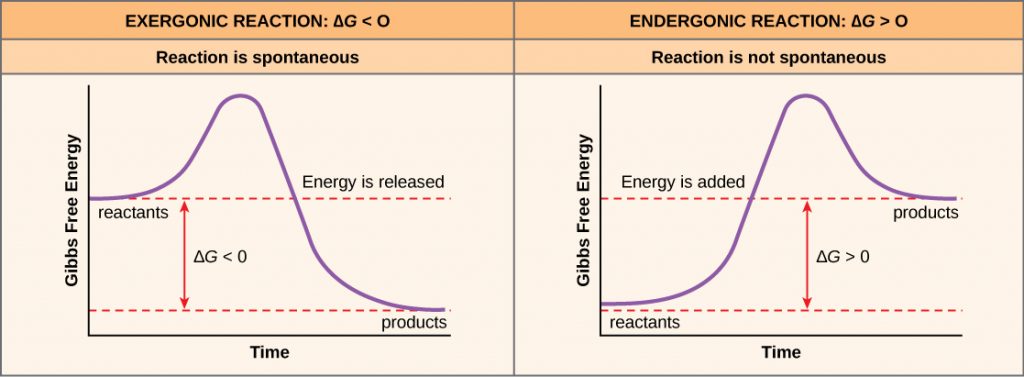
Om en kemisk reaktion absorberar energi snarare än frigör energi i balans, kommer ΔG för den reaktionen att vara ett positivt värde. I detta fall har produkterna mer fri energi än reaktanterna. Produkterna av dessa reaktioner kan således betraktas som energilagrande molekyler. Dessa kemiska reaktioner kallas endergoniska reaktioner och de är icke-spontana.
En endergonisk reaktion sker inte av sig själv utan att fri energi tillförs.

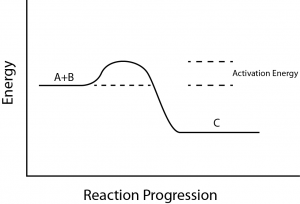
Det finns ytterligare ett viktigt begrepp som måste beaktas när det gäller endergoniska och exergoniska reaktioner. Exergoniska reaktioner kräver en liten mängd tillförd energi för att komma igång, innan de kan fortsätta med sina energiutlösande steg.
Dessa reaktioner har en nettofrigörelse av energi, men kräver fortfarande en viss energitillförsel i början. Denna lilla mängd energiinsats som krävs för att alla kemiska reaktioner ska inträffa kallas aktiveringsenergi (figur 3).
Om inte annat anges är bilderna på den här sidan licensierade under CC-BY 4.0 av OpenStax.
Texten är anpassad från: OpenStax, Concepts of Biology. OpenStax CNX. 18 maj 2016 http://cnx.org/contents/[email protected]
.