Förtida idéer om materia: Från Demokrit till Dalton
Moderna atomteorier

Priestley, Lavoisier och andra hade lagt grunden för kemin. Deras experiment visade att vissa ämnen kunde kombineras med andra för att bilda nya material, andra ämnen kunde brytas isär för att bilda enklare ämnen, och några viktiga ”grundämnen” kunde inte brytas ner ytterligare. Men vad kunde förklara denna komplexa uppsättning observationer? John Dalton, en exceptionell brittisk lärare och vetenskapsman, satte ihop bitarna och utvecklade den första moderna atomteorin 1803. Om du vill lära dig mer om Priestleys och Lavoisiers experiment och hur de låg till grund för Daltons teorier kan du prova det interaktiva experimentet Dalton’s Playhouse, som länkas till nedan.
Dalton gjorde det till en regelbunden vana att följa och registrera vädret i sin hemstad Manchester, England. Genom sina observationer av morgondimma och andra vädermönster insåg Dalton att vatten kunde existera som en gas som blandades med luft och upptog samma utrymme som luft. Fasta ämnen kunde inte uppta samma utrymme som varandra; is kunde till exempel inte blandas med luft. Så vad är det som gör att vatten ibland beter sig som en fast substans och ibland som en gas? Dalton insåg att all materia måste bestå av små partiklar. I gastillstånd flyter dessa partiklar fritt omkring och kan blandas med andra gaser, vilket Bernoulli hade föreslagit. Men Dalton utvidgade denna idé till att gälla all materia – gaser, fasta ämnen och vätskor. Dalton föreslog först en del av sin atomteori 1803 och förfinade senare dessa begrepp i sin klassiska uppsats A New System of Chemical Philosophy från 1808 (som du kan komma åt via en länk under fliken Resurser).
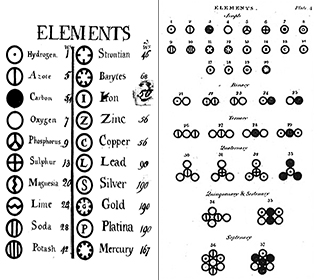
Daltons teori hade fyra huvudbegrepp:
-
Alla materia består av odelbara partiklar som kallas atomer. Bernoulli, Dalton och andra föreställde sig atomer som små biljardbollsliknande partiklar i olika rörelsetillstånd. Även om detta koncept är användbart för att hjälpa oss att förstå atomer är det inte korrekt, vilket vi kommer att se i senare moduler om atomteori som länkas till längst ner i den här modulen.
-
Alla atomer av ett givet grundämne är identiska; atomer av olika grundämnen har olika egenskaper. Daltons teori föreslog att varje enskild atom av ett grundämne, till exempel syre, är identisk med varje annan syreatom; dessutom är atomer av olika grundämnen, till exempel syre och kvicksilver, olika från varandra. Dalton karakteriserade grundämnen enligt deras atomvikt; när isotoper av grundämnen upptäcktes i slutet av 1800-talet ändrades dock detta koncept.
-
Kemiska reaktioner innebär att atomer kombineras, inte att atomer förstörs. Atomer är oförstörbara och oföränderliga, så föreningar, till exempel vatten och kvicksilverkalx, bildas när en atom kombineras kemiskt med andra atomer. Detta var ett extremt avancerat koncept för sin tid; även om Daltons teori antydde att atomer band sig till varandra skulle det dröja mer än 100 år innan vetenskapsmännen började förklara begreppet kemisk bindning.
-
När grundämnena reagerar för att bilda föreningar reagerar de i definierade, hela tals proportioner. De experiment som Dalton och andra utförde visade att reaktioner inte är slumpmässiga händelser utan att de sker enligt exakta och väldefinierade formler. Detta viktiga begrepp inom kemin diskuteras närmare nedan.
Förståelsekontrollpunkt
Ett grundämne består av
En del av detaljerna i Daltons atomteori kräver en närmare förklaring.
Element: Redan 1660 insåg Robert Boyle att den grekiska definitionen av element (jord, eld, luft och vatten) inte var korrekt. Boyle föreslog en ny definition av ett grundämne som ett grundläggande ämne, och vi definierar nu grundämnen som grundläggande ämnen som inte kan brytas ner ytterligare med kemiska medel. Elementen är universums byggstenar. De är rena ämnen som utgör grunden för alla material i vår omgivning. Vissa grundämnen kan ses i ren form, t.ex. kvicksilver i en termometer, andra ser vi främst i kemisk kombination med andra, t.ex. syre och väte i vatten. Vi känner nu till ungefär 116 olika grundämnen. Varje grundämne har ett namn och en förkortning på en eller två bokstäver. Ofta är denna förkortning helt enkelt grundämnets första bokstav; till exempel förkortas väte med H och syre med O. Ibland ges ett grundämne en förkortning med två bokstäver; till exempel är helium He. När man skriver förkortningen för ett grundämne skrivs den första bokstaven alltid med stor bokstav och den andra bokstaven (om det finns en) alltid med liten bokstav.
Atomer: En enda enhet av ett grundämne kallas atom. Atomen är den mest grundläggande materiaenheten, som utgör allt i vår omvärld. Varje atom behåller alla kemiska och fysikaliska egenskaper hos sitt överordnade grundämne. I slutet av 1800-talet visade forskare att atomer i själva verket består av mindre, ”subatomära” delar, vilket krossade biljardbollsuppfattningen om atomen (se vår modul Atomteori I: De tidiga dagarna).
Föreningar: De flesta material som vi kommer i kontakt med är föreningar, ämnen som bildas genom den kemiska kombinationen av två eller flera atomer av grundämnena. En enda ”partikel” av en förening kallas en molekyl. Dalton föreställde sig felaktigt att atomer ”hakade” ihop sig för att bilda molekyler. Dalton insåg dock korrekt att föreningar har exakta formler. Vatten, till exempel, består alltid av två delar väte och en del syre. Den kemiska formeln för en förening skrivs genom att man räknar upp symbolerna för grundämnena tillsammans, utan mellanrum mellan dem. Om en molekyl innehåller mer än en atom av ett grundämne, skrivs en siffra efter symbolen för att visa hur många atomer av det grundämnet som finns i molekylen. Formeln för vatten är alltså H2O, aldrig HO eller H2O2.
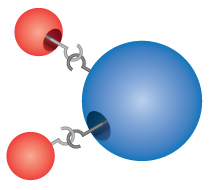
Comprehension Checkpoint
The formula for water can be written as either H2O or HO2.