H2S Lewis Structure, Molecular Geometry, Hybridization and Polarity
Hydrogen Sulfide is a common chemical compound that is useful for analyzing inorganic compounds of metal ions. It has the chemical formula of H2S. The molecule has two Hydrogen atoms and a single Sulfur atom. H2S is also a precursor for elemental Sulfur. It also plays a vital role in signaling pathways in the human body. So to understand the hybridization, polarity, and molecular geometry of this compound, it is essential to know its Lewis structure.
| Name of molecule | Hydrogen Disulfide ( H2S) |
| No of Valence Electrons in the molecule | 8 |
| Hybridization of CO2 | sp3 hybridization |
| Bond Angles | 104.5 degrees |
| Molecular Geometry of CO2 | Bent |
Before knowing its Lewis structure, let us calculate the total number of valence electrons in Hydrogen Sulfide as these electrons participate in bond formation and help us study Lewis structure with ease.
Contents
Valence electrons of H2S
To know the total number of valence electrons in Hydrogen Sulfide we need to add the valence electrons of both Hydrogen and Sulfur atoms. There are two atoms of Hydrogen and a single atom of Sulfur in the compound.
Each Hydrogen atom has only one electron which is also its valence electron
Hence there are two valence electrons for Hydrogen atom ( as there are two Hydrogen atoms)
Sulfur has six valence electrons.
Total number of valence electrons in H2S
= 2(1) + 6
= 8
Thus, there are a total of eight valence electrons in H2S.
H2S Lewisstruktur
Lewisstrukturen för en förening är en strukturell representation av de valenceelektroner som deltar i bindningsbildningen tillsammans med de icke-bindande elektronparen. Det är viktigt att känna till Lewisstrukturen för en viss kemisk förening eftersom den ger nödvändig information om alla andra kemiska egenskaper hos föreningen.
Den framställningen visas med hjälp av prickar och linjer som representerar elektroner. Punkter representerar de elektroner som inte deltar i bindningsbildningen. Medan linjerna representerar bindningarna i föreningen. Strukturen görs utifrån oktettregeln. Kemiens oktettregel säger att det ska finnas åtta elektroner i det yttre skalet hos ett grundämne för att det ska vara stabilt.
Lewisstrukturen för vätesulfid är lätt att rita och förstå. I denna förening behöver båda väteatomerna en elektron för att skapa en kovalent bindning med svavel. Lewisstrukturen för H2S liknar H2S. Svavel behöver åtta elektroner för att uppfylla kraven för oktettregeln. Men väte behöver bara en enda elektron för att bli stabilt eftersom det tillhör grundämnena i grupp 1.
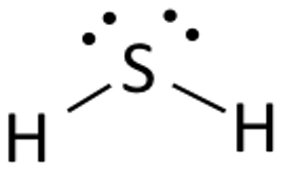
Placera svavelatomen i mitten och ordna dess valenselektroner runt den.
Placera nu två väteatomer på båda sidor om den centrala atomen.
Här används svavelns valenceelektroner för att göra väte stabilt genom att donera en elektron till båda väteatomerna. Två av sex valenceelektroner deltar i bindningsbildningen.
Rita linjer ( för att visa bindningar) mellan väte- och svavelatomer.
De återstående fyra elektronerna är icke-bindande elektroner och visas därför som prickar nära svavelatomen. Totalt finns det två par icke-bindande elektroner i denna förening och väteatomerna har ett komplett valensskal.
H2S hybridisering
För att förstå hybridiseringen av H2S är det viktigt att veta två saker först:
- Antalet bindningar i föreningen och dess typ
Det är viktigt att känna till typen av bindningar i föreningen för att känna till dess hybridisering. I H2S-molekylen bildar två väteatomer en bindning med den centrala svavelatomen. Två enkelbindningar bildas i molekylen. Dessa bindningar tar upp fyra valenceelektroner och därmed finns det fyra andra valenceelektroner kvar. När en bindning bildas överlappar väteatomens s-orbital med s-orbitalet hos svavelatomen. Det ensamma elektronparet tar upp två av sp3-orbitalerna. De andra två sp3-orbitalerna överlappar med väteatomens 1s-borgital.
Detta arrangemang leder till sp3-hybridisering av H2S-molekylen. Överlappningen av de två hybridorbitalerna bildar två sigma-bindningar mellan väte- och svavelatomen.
- Det steriska talet för den givna föreningen
Det steriska talet definieras som den region av elektrontäthet som ses runt den centrala atomen. I detta fall, eftersom svavel är den centrala atomen, kommer föreningens steriska nummer att vara den kumulativa summan av atomer som är bundna till den centrala atomen och antalet ensamma elektronpar runt den centrala atomen.
Formeln för att hitta detta nummer är:
Steriskt nummer (SN)
= Antal sigma-bindningar på den centrala atomen +Antal pi-lönepar på den centrala atomen
I detta fall av H2S-molekyler finns det två sigma-bindningar, och det finns två lonepar av elektroner på den centrala atomen.

Därmed är SN för H2S-molekylen = 2+2
=4
Som Steric-nummeret för H2S är fyra har den två
hybridorbitaler och två ensamma elektronpar som gör att det är en sp3-hybridisering.
När vi nu känner till molekylens Lewisstruktur och hybridisering är det lätt att bestämma dess molekylgeometri.
H2S molekylgeometri
Hybridisering av den givna molekylen H2S är sp3; svavelatomen är i centrum som binder med två väteatomer som bildar bindningsvinkel mindre än 180 grader. Enligt VSEPR-teorin stöter de ensamma elektronparen bort varandra, men eftersom svavelatomen är mindre elektronegativ minskar bindningsvinkeln till 104,5 grader.
Denna minskning av vinkeln leder till en böjd struktur.
Ett annat sätt att känna till molekylär geometri är genom AXN-metoden. Där A betecknar den centrala atomen, X står för antalet bundna elektronpar och N står för det ensamma elektronparet. Här blir den allmänna formeln AX2N2 på grund av två bindningspar och två ensamma elektronpar. Denna molekyl uppvisar alltså en böjd geometri.
H2S polaritet
När vi nu har den nödvändiga informationen om molekylen är det lätt att bestämma dess polaritet. Polariteten hos en given molekyl beror på dess molekylära geometri och den totala elektronegativiteten. Eftersom svavelatomen är mindre elektronegativ är föreningens totala elektronegativitet mindre än 0,4, vilket gör den opolär.
Därmed kan man säga att H2S-molekylen är opolär.
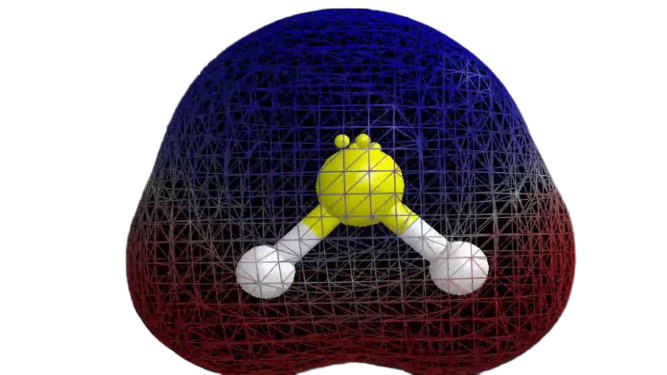
Slutord
Utifrån ovanstående information kan man dra slutsatsen att H2S-molekylen har åtta valenselektroner, sp3-hybridisering, böjd molekylärgeometri och är opolär.