Kemi för icke-studenter
Lärandemål
- Definiera atomradie.
- Beskriv hur atomen förändras inom en period.
- Beskriv hur atomradion förändras inom en grupp.
Hur kan alla dessa människor rymmas på ett så litet utrymme?
 Evenemang lockar till sig ett stort antal människor. Till och med ett evenemang utomhus kan fyllas så att det inte finns plats för fler människor. Publikkapaciteten beror på mängden utrymme i lokalen, och mängden utrymme beror på storleken på de föremål som fyller lokalen. Vi kan få in fler människor i ett givet utrymme än vad vi kan få in elefanter, eftersom elefanter är större än människor. Vi kan få in fler ekorrar i samma utrymme än vi kan få in människor av samma anledning. Att känna till storleken på de objekt vi har att göra med kan vara viktigt för att avgöra hur mycket utrymme som behövs.
Evenemang lockar till sig ett stort antal människor. Till och med ett evenemang utomhus kan fyllas så att det inte finns plats för fler människor. Publikkapaciteten beror på mängden utrymme i lokalen, och mängden utrymme beror på storleken på de föremål som fyller lokalen. Vi kan få in fler människor i ett givet utrymme än vad vi kan få in elefanter, eftersom elefanter är större än människor. Vi kan få in fler ekorrar i samma utrymme än vi kan få in människor av samma anledning. Att känna till storleken på de objekt vi har att göra med kan vara viktigt för att avgöra hur mycket utrymme som behövs.
Atomernas storlek är viktig när man försöker förklara atomers eller föreningars beteende. Ett av sätten vi kan uttrycka atomernas storlek på är med atomradien . Dessa uppgifter hjälper oss att förstå varför vissa molekyler passar ihop och varför andra molekyler har delar som blir för trånga under vissa förhållanden.
Storleken på en atom definieras av kanten på dess orbital. Orbitalgränserna är dock luddiga och varierar faktiskt under olika förhållanden. För att standardisera mätningen av atomradier mäts avståndet mellan atomkärnorna hos två identiska atomer som är bundna till varandra. Atomradien definieras som halva avståndet mellan atomkärnorna hos identiska atomer som är bundna till varandra.

Figur 1. En atoms atomradie (r) kan definieras som halva avståndet (d) mellan två atomkärnor i en tvåatomig molekyl.
Atomradier har uppmätts för grundämnen. Enheterna för atomradier är pikometer, vilket motsvarar 10-12 meter. Som exempel kan nämnas att det interkärniga avståndet mellan de två väteatomerna i en H2-molekyl mäts till 74 pm. Därför är atomradien för en väteatom \frac{74}{2}=37\text{ pm}.
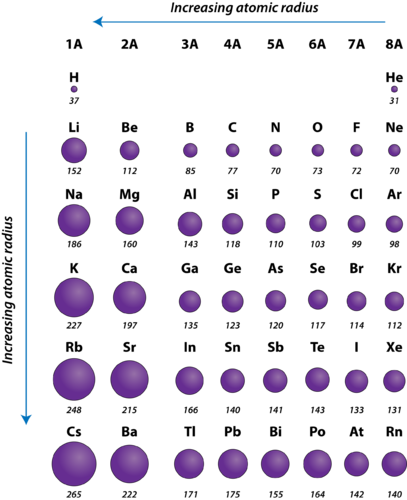
Figur 2. Atomradier för de representativa grundämnena mätt i pikometer.
Periodisk trend
Atomernas atomradier minskar i allmänhet från vänster till höger över en period. Det finns några små undantag, till exempel att syreradien är något större än kväveradien. Inom en period läggs protoner till kärnan samtidigt som elektroner läggs till på samma huvudsakliga energinivå. Dessa elektroner dras gradvis närmare kärnan på grund av dess ökade positiva laddning. Eftersom attraktionskraften mellan kärnor och elektroner ökar, minskar atomernas storlek. Effekten minskar när man rör sig längre till höger i en period på grund av elektron-elektronavstötningar som annars skulle få atomens storlek att öka.
Gruppstrend
Atomernas atomradie ökar generellt sett uppifrån och ned inom en grupp. När atomnumret ökar nedåt i en grupp sker återigen en ökning av den positiva kärnladdningen. Det sker dock också en ökning av antalet ockuperade principiella energinivåer. Högre principiella energinivåer består av orbitaler som är större än orbitaler från lägre energinivåer. Effekten av det större antalet principiella energinivåer uppväger ökningen av kärnladdningen och därför ökar atomradien nedåt i en grupp.

Figur 3. A graph of atomic radius plotted versus atomic number. Each successive period is shown in a different color. As the atomic number increases within a period, the atomic radius decreases.
Summary
- Atomic radius is determined as the distance between the nuclei of two identical atoms bonded together.
- The atomic radius of atoms generally decreases from left to right across a period.
- The atomic radius of atoms generally increases from top to bottom within a group.
Practice
Use the link below to answer the following questions:
http://chemwiki.ucdavis.edu/Inorganic_Chemistry/Descriptive_Chemistry/Periodic_Table_of_the_Elements/Atomic_Radi
- What influences the atomic size of an atom?
- What is a covalent radius?
- What is an ionic radius?
Review
- Define ”atomic radius.”
- What are the units for measurement of atomic radius?
- How does the atomic radius change across a period?
- How does atomic radius change from top to bottom within a group?
- Explain why the atomic radius of hydrogen is so much smaller that the atomic radius for potassium.