Mjösjukdom
Översikt
Det första fallet av anaplasmos hos människor beskrevs 1990, då en patient i Wisconsin utvecklade en allvarlig febril sjukdom efter ett fästingbett och dog två veckor senare. Blodutstryk visade kluster av bakterier i patientens neutrofiler, som liknade de morulae som ses i monocyter vid E. chaffeensis-infektion. Odlingar och serologiska tester för E. chaffeensis var dock negativa. Patientens kliniska förlopp tydde dock på ehrlichios av något slag, och när flera ytterligare fall av sjukdomen rapporterades i norra mellanvästern under de följande åren, antogs det att en ny art av Ehrlichia kunde vara på väg att växa fram. Den nya sjukdomen fick preliminärt namnet ”human granulocytisk ehrlichiosis” eller HGE.
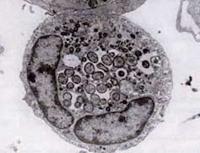
Under 1994 avslöjade DNA-sekvenseringsstudier att HGE-agenset var klart skilt från E. chaffeensis men i huvudsak identiskt med två tidigare kända ehrlichiala veterinärpatogener, E. equi och E. (Cytoecetes) phagocytophila. Enligt ett nytt taxonomiskt system som sedan dess har införts har dessa tre organismer förenats som en enda art inom ett nytt släkte, Anaplasma. Den nya arten kallas Anaplasma phagocytophilum, och den sjukdom som den orsakar är nu känd som human granulocytär anaplasmos eller HGA.
Likt Ehrlichia-arter är Anaplasma-organismerna små, gramnegativa och intracellulära. A. phagocytophilum är inriktad på neutrofiler, ändrar deras funktion i värden och bildar morulae i vakuoler. De flesta av de skador som den orsakar tycks vara relaterade till värdens inflammatoriska processer, eftersom det finns få bevis för en korrelation mellan antalet organismer och värdens sjukdomsgrad.
Anaplasmos är en global infektion som förekommer i Nordamerika, större delen av Europa och östra Asien. Vektorer är fästingar från Ixodes persulcatus-komplexet: I. scapularis i nordöstra och övre Mellanvästern i USA, I. pacificus i nordvästra Stilla havet, I. ricinus i Europa och I. persulcatus i Asien. A. phagocytophilum upprätthålls i naturen genom att den cirkulerar mellan dessa fästingar och olika små däggdjur, främst möss och andra små gnagare. Eftersom Ixodes- fästingar också är vektorer för borrelia, babesios och fästingburen encefalit, kan Anaplasma- och dessa sjukdomar tillsammans med Anaplasma förekomma hos människor och gör det också.
I USA har fallen av HGA varit fler än fallen av human monocytär ehrlichios (HME) I likhet med HME och human ewingii ehrlichios är medianåldern för patienter med HGA omkring 50 år.
Signaler och symtom
Det kliniska förloppet av HGA sträcker sig från asymtomatisk infektion till dödlig sjukdom. De första symptomen, som uppträder cirka fem till tio dagar efter fästingbett, är i stort sett ospecifika: feber, frossa, svår huvudvärk och myalgi;j illamående, hosta och arthralgi kan också förekomma. HGA är ovanligt men har rapporterats.
Vid jämförelse med HME verkar det mindre sannolikt att HGA involverar det centrala nervsystemet, men perifera neuropatier (t.ex. domningar och stickningar) är vanligare och kan pågå i veckor till månader. Bland de neurologiska fynd som rapporterats i den medicinska litteraturen finns facialispares, demyeliniserande polyneuropati och brachial plexopati. Andningssvårigheter och ett septiskt eller toxiskt chockliknande syndrom har rapporterats, men verkar vara mindre vanliga än vid HME. Den totala dödligheten till följd av HGA är mycket låg (mindre än 1 %), och de flesta dödsfallen beror på opportunistiska infektioner (t.ex. herpes simplex esofagit, Candida-pneumonit och pulmonell aspergillos) hos immunsupprimerade patienter.
Diagnos
Standardblodprover vid HGA avslöjar vanligtvis fynd som liknar dem som ses vid HME: leukopeni, trombocytopeni och leverfunktionsavvikelser (förhöjda transaminaser). De hematologiska avvikelserna försvinner dock ofta under den andra veckan av symtomen, så deras frånvaro bör tolkas i det sammanhanget om patienterna presenterar sig senare under sjukdomsförloppet. I allmänhet bör empirisk antibiotikabehandling övervägas för patienter i endemiska områden som uppvisar en akut febril sjukdom som tyder på HGA.
För specifik diagnos har Wright- eller Giemsa-färgade blodutstryk ett något högre utbyte än med HME, men de är fortfarande inte optimala för allmän klinisk användbarhet, med tanke på att det tycks finnas en stor variation (25-75 %) i känsligheten hos dessa tester när det gäller att synliggöra morulae i värdens neutrofiler. Mer användbara, men inte alltid tillgängliga, är tester med polymeraskedjereaktion (PCR), som beräknas ha en känslighet på 67-90 %. Tidigare antibiotikabehandling minskar dramatiskt känsligheten hos båda dessa diagnostiska metoder.
Serologiska tester är användbara för att bekräfta diagnosen av anaplasmos. Den vanligaste metoden är indirekt immunofluorescens (IFA) av IgM- och IgG-antikroppar mot A. phagocytophilum. Serokonversion är kanske det känsligaste laboratoriebeviset på A. phagocytophilum-infektion, men erhålls inte alltid i tillräckligt god tid för att ge användbar information om kliniska beslut (dvs. behandling).