Syrefamiljen
Syrefamiljen består av de grundämnen som ingår i grupp 16 i det periodiska systemet: syre, svavel, selen, tellur och polonium. Dessa grundämnen har alla sex elektroner i sin yttersta energinivå, vilket förklarar vissa gemensamma kemiska egenskaper bland dem. I ett annat avseende skiljer sig grundämnena ganska mycket från varandra. Syre är en gasformig icke-metall, svavel och selen är fasta icke-metaller, tellur är en fast metalloid och polonium är en fast metall.
Ord att känna till
Syra: Ämnen som när de är lösta i vatten kan reagera med en bas för att bilda salter och frigöra vätejoner.
Allotrope: En av två eller flera former av ett grundämne.
Förbränning: En form av oxidation som sker så snabbt att märkbar värme och ljus produceras.
Sprickbildning: Den process genom vilken stora kolvätemolekyler bryts ner till mindre komponenter.
Elektrolys: Processen genom vilken en elektrisk ström orsakar en kemisk förändring, vanligtvis nedbrytning av något ämne.
Isotoper: Två eller flera former av samma grundämne med samma antal protoner men olika antal neutroner i atomkärnan.
Lithosfär: Den fasta delen av jorden, särskilt den yttre jordskorpan.
LOX: En förkortning för flytande syre.
Metallurgi: Vetenskap och teknik som handlar om att utvinna metaller ur sina malmer och omvandla dem till former som har ett praktiskt värde.
Syresättning: En allotrope av syre vars molekyler var och en innehåller en enda syreatom.
Ozon: En allotrope av syre som består av tre atomer per molekyl.
Producentgas: Ett syntetiskt bränsle som huvudsakligen består av kolmonoxid- och vätegaser.
Proteiner: Stora molekyler som är viktiga för alla levande cellers struktur och funktion.
Radioaktivt sönderfall: Det förutsägbara sätt på vilket en population av atomer av ett radioaktivt grundämne spontant sönderfaller med tiden.
Syre
Syre är en färglös, luktfri och smaklös gas med en smältpunkt på -218°C (-360°F) och en kokpunkt på -183°C (-297°F). Det är det vanligaste grundämnet i jordskorpan och utgör ungefär en fjärdedel av atmosfären i vikt, ungefär hälften av litosfären (jordskorpan) och ungefär 85 procent av hydrosfären (haven, sjöar och andra former av vatten). Det förekommer både som fritt grundämne och i ett stort antal föreningar. I atmosfären finns det som elementärt syre, som ibland kallas dioxin eftersom det består av tvåatomiga molekyler, O 2 . I vatten förekommer det som väteoxid, H 2 O, och i litosfären förekommer det i föreningar som oxider, karbonater, sulfater, silikater, fosfater och nitrater.
Syre finns också i två allotropa former (fysiskt eller kemiskt olika former av samma ämne): en atom per molekyl (O) och tre atomer per molekyl (O 3 ). Den förstnämnda allotropen är känd som monatomiskt, eller nasalt, syre och den sistnämnda som triatomiskt syre, eller ozon. Under de flesta omständigheter i naturen dominerar den diatomära formen av syre. I den övre delen av stratosfären orsakar solenergi dock en nedbrytning av den diatomära formen till den monatomära formen, som sedan kan rekombineras med diatomära molekyler för att bilda ozon. Förekomsten av ozon i jordens atmosfär är avgörande för livets överlevnad på jorden eftersom denna allotrop har en tendens att absorbera ultraviolett strålning som annars skulle vara skadlig eller till och med dödlig för både växter och djur på planetens yta.
Oxygen upptäcktes oberoende av varandra av den svenske kemisten Carl Scheele (1742-1786) och den engelske kemisten Joseph Priestley (1733-1804) mellan 1773 och 1774. Grundämnet fick sitt namn i slutet av 1770-talet av den franske kemisten Antoine Laurent Lavoisier (1743-1794). Dess namn kommer från det franska ordet för ”syrabildare”, vilket återspeglar Lavoisiers felaktiga uppfattning att alla syror innehåller syre.
Produktion. Den överlägset vanligaste metoden för kommersiell framställning av syre är fraktionerad destillation av flytande luft. Ett luftprov kyls först ner till en mycket låg temperatur i storleksordningen -200°C (-330°F). Vid denna temperatur blir de flesta gaser som ingår i luften flytande. Den flytande luften får sedan avdunsta. Vid en temperatur på cirka -196 °C (-320 °F) börjar kväve koka bort. När det mesta av kvävet är borta kokar även argon och neon bort och lämnar kvar en oren form av syre. Syret är orent eftersom små mängder krypton, xenon och andra gaser kan finnas kvar i den flytande formen. För att ytterligare rena syret kan man upprepa processen med nedkylning, förtätning och avdunstning.
Syre lagras och transporteras vanligen i flytande form, en form som också kallas LOX (för l iquid ox ygen). LOX-behållare ser ut som mycket stora vakuumflaskor som består av en dubbelväggig behållare med vakuum mellan väggarna. Elementet kan också lagras och transporteras mindre lätt i gasform i stålväggiga behållare som är cirka 1,2 meter höga och 23 centimeter i diameter. I många fall tillverkas syret på den plats där det ska användas. Den tidigare beskrivna processen med fraktionerad destillation är tillräckligt enkel och billig för att många industrier ska kunna tillhandahålla sina egna anläggningar för syreproduktion.
Användning. Syre har så många kommersiella, industriella och andra användningsområden att det konsekvent tillhör de fem största kemikalierna när det gäller produktionsvolym i USA. År 1990 tillverkades till exempel cirka 18 miljarder kilo (39 miljarder pund) av grundämnet i USA.
De användningsområden som syre har kan delas in i fyra huvudkategorier: metallurgi, raketer, kemisk syntes och medicin. Vid bearbetning av järnmalm i en masugn används syre till exempel för att omvandla koks (kol) till kolmonoxid. Kolmonoxiden reducerar i sin tur järnoxider till ren järnmetall. Syre används sedan i ett andra steg av järnbearbetningen i Bessemerkonverteringen, den öppna härden eller den grundläggande syreprocessen för att omvandla ”tackjärn” till stål. I detta steg används syret för att reagera med det överskott av kol, kisel och metaller som finns kvar i tackjärnet och som måste avlägsnas för att stål ska kunna framställas.
En annan metallurgisk tillämpning av syre är i brännare som används för svetsning och skärning. De två vanligaste facklorna använder sig av reaktionen mellan syre och väte (oxyhydrogenbrännare) eller mellan syre och acetylen (oxyacetylenbrännare). Båda typerna av brännare ger temperaturer på 3 000 °C (5 400 °F) eller mer och kan därför användas för att skära genom eller svetsa de allra flesta metalliska material.
I form av LOX används syre i stor utsträckning som oxidationsmedel i många typer av raketer och missiler. Den enorma externa bränsletank som krävs för att lyfta rymdfärjan ut i rymden innehåller till exempel 550 000 liter flytande syre och 1 500 000 liter flytande väte. När dessa två ämnen reagerar i rymdfärjans huvudmotorer ger de en maximal dragkraft på 512 000 pund.
Den kemiska industrin använder stora mängder syre varje år i en mängd olika kemiska syntesreaktioner (bildningsreaktioner). En av de viktigaste av dessa är krackning av kolväten med hjälp av syre. Under de flesta omständigheter leder uppvärmning av ett kolväte med syre till förbränning, med koldioxid och vatten som huvudprodukter. Om den hastighet med vilken syre tillförs en kolväteblandning kontrolleras noggrant ”knäcks” kolvätena eller bryts sönder för att producera andra produkter, t.ex. acetylen, eten och propylen.
Olika typer av syntetiska bränslen kan också tillverkas med syre som en av huvudreaktanterna. Producentgas tillverkas till exempel genom att syre leds med kontrollerad hastighet genom en bädd av varmt kol eller koks. Huvuddelen av den koldioxid som produceras i denna reaktion reduceras till kolmonoxid så att slutprodukten (producentgasen) huvudsakligen består av kolmonoxid och väte.
Den kanske mest kända medicinska tillämpningen av syre är syrebehandling, där patienter som har svårt att andas får doser av rent eller nästan rent syre. Syrgasbehandling används ofta under kirurgiska ingrepp, under förlossning, under återhämtning efter hjärtinfarkt och under behandling av infektionssjukdomar. I alla dessa fall minskar den person som får rent syre belastningen på hjärta och lungor och återhämtar sig snabbare.
Rent syre eller syreberikad luft kan också tillhandahållas i miljöer där det kan vara svårt att andas. Flygplan som flyger på hög höjd har naturligtvis alltid syreförråd om det skulle uppstå problem med fartygets normala lufttillförsel. Djuphavsdykare har också med sig eller får pumpad luft som är berikad med syre.
Vissa vattenrenings- och avloppsreningsverk använder syre. Gasen pumpas genom vatten för att öka hastigheten med vilken naturligt förekommande bakterier bryter ner organiskt avfallsmaterial. En liknande process har visat sig minska den hastighet med vilken övergödning sker i sjöar och dammar och i vissa fall faktiskt vända processen. (Eutrofiering är upplösning av näringsämnen i en vattenmassa. Tillväxt av vattenväxter och en minskning av löst syre är de två viktigaste resultaten av processen).
Slutligen är syre viktigt för allt djurliv på jorden. En människa kan överleva några dagar eller veckor utan vatten eller mat men inte mer än några minuter utan syre. I avsaknad av syre skulle de energigenererande kemiska reaktioner som äger rum i cellerna upphöra och en människa skulle dö.
Svavel
Svavel är ett icke-metalliskt grundämne som kan existera i många allotropa former (fysiskt eller kemiskt olika former av samma ämne). De mest kända kallas rombiskt och monokliniskt svavel. Båda är ljusgula fasta ämnen med en smältpunkt på cirka 115 °C (239 °F). En tredje form kallas plastiskt eller amorft svavel. Det är en brunaktig vätska som bildas när rombiskt eller monokliniskt svavel smälts.
Svavel i sig har ingen lukt alls. Det har dock ett dåligt rykte i detta avseende eftersom vissa av dess vanligaste föreningar har starka lukter. Svaveldioxid, en av dessa föreningar, har en skarp, kvävande, kvävande effekt på alla som andas in den. Bibelns ”eld och svavel” var ett av de värsta straff som dess författare kunde föreställa sig. Svavelstenen i detta uttryck syftade på brinnande svavel, eller svaveldioxid. Det faktum att svavel kommer från djupt under jorden och att svaveldioxid kan luktas i rök från vulkaner gav ytterligare bränsle åt människors föreställningar om hur helvetet måste vara.
En annan svavelförening med dålig lukt är vätesulfid. Den starka lukten av ruttna ägg beror på förekomsten av denna förening.
Förekomst och framställning. Svavel är det sextonde vanligaste grundämnet i jordskorpan. Det förekommer både som grundämne och i en mängd olika föreningar. Som grundämne kan det hittas i mycket stora, underjordiska gruvor, vanligast längs USA:s golfkust samt i Polen och på Sicilien. Svaveln utvinns ur dessa gruvor med hjälp av Frasch-processen. I denna process pumpas överhettad ånga genom det yttersta av tre rör. Komprimerad luft trycks ner i det innersta röret. Den överhettade ångan får den underjordiska svaveln att smälta, och den komprimerade luften driver den uppåt, genom det mittersta av de tre rören, till jordens yta.
Svavel finns också utbrett i form av mineraler och malmer. Många av dessa är i form av sulfater, bland annat gips (kalciumsulfat, CaSO 4 ), baryt (bariumsulfat, BaSO 4 ) och Epsom-salt (magnesiumsulfat, MgSO 4 ). Andra är metallsulfider, däribland järnpyriter (järnsulfid, FeS 2 ), galena (blysulfid, PbS), cinnober (kvicksulfid, HgS), stibnit (antimonsulfid, Sb 2 S 3 ) och zinkblände (zinksulfid, ZnS). Svaveln återvinns från dessa metallmalmer genom kraftig upphettning i luft, vilket omvandlar svavlet till svaveldioxid och frigör den rena metallen. Därefter kan svaveldioxiden gå direkt till tillverkning av svavelsyra, vilket är där mer än 90 procent av världens utvunna svavel hamnar.
Användning av svavel och dess föreningar. En del svavel används direkt som svamp- och insektsbekämpningsmedel, i tändstickor, fyrverkerier och krut samt vid vulkanisering av naturgummi (en behandling som ger gummi elasticitet och styrka). Det mesta omvandlas dock till en mängd användbara föreningar.
Svavelsyra är den överlägset viktigaste av alla svavelföreningar. Nästan 90 procent av allt svavel som produceras omvandlas först till svaveldioxid och sedan till svavelsyra. Syran rankas konsekvent som nummer ett bland de kemikalier som produceras i USA. År 1990 tillverkades mer än 40 miljarder kilo (89 miljarder pund) svavelsyra, mer än 50 procent så mycket som den näst mest populära kemikalien (kvävgas). Svavelsyra används vid tillverkningen av gödningsmedel, bilbatterier, petroleumprodukter, pigment, järn och stål och många andra produkter.
Svavelcykeln. Liksom kväve, kol och fosfor passerar svavel genom de gasformiga, flytande och fasta delarna av vår planet i en serie kontinuerliga reaktioner som kallas svavelcykeln. De viktigaste stegen i svavelcykeln illustreras i den bifogade figuren.
Svavel produceras naturligt som ett resultat av vulkanutbrott och genom utsläpp från varma källor. Det kommer in i atmosfären främst i form av svaveldioxid och stannar sedan kvar i atmosfären i den formen eller, efter att ha reagerat med vatten, i form av svavelsyra. Svavel transporteras tillbaka till jordens yta som surt nedfall när det regnar eller snöar.
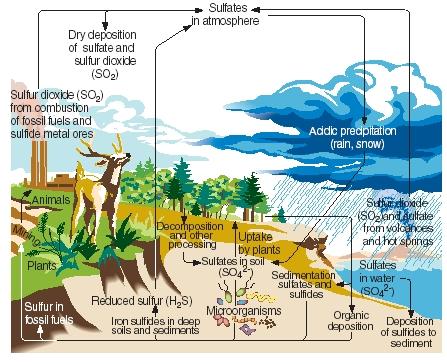
.)
På jordens yta reagerar svaveldioxid och svavelsyra med metaller för att bilda sulfater och sulfider. Grundämnet införlivas också av växter i en form som kallas organiskt svavel. Vissa aminosyror, de föreningar som proteiner tillverkas av, innehåller svavel. Organiskt svavel från växter överförs så småningom till djur som äter dessa växter. Det omvandlas i sin tur från växtproteiner till djurproteiner.
När växter och djur dör återförs svavel till jorden där det omvandlas av mikroorganismer till vätesulfid. Svavelvätegasen återförs sedan till atmosfären där den oxideras till svavelsyra.
Mänsklig verksamhet påverkar svavelcykeln på flera sätt. När kol och metalliska malmer bryts kan till exempel svavel och sulfider frigöras och återföras till marken. Även vid förbränning av kol, olja och naturgas släpps ofta svaveldioxid ut i atmosfären. Denna svaveldioxid läggs till den mängd som redan finns från naturliga källor, vilket kraftigt ökar mängden sur nederbörd som faller till jordens yta. Vissa människor anser att sur nederbörd (eller surt regn) är orsaken till att träd och andra växter dör, att sjöar försuras vilket har skadat marina djur, att metall- och stenkonstruktioner skadas och att andra miljöskador uppstår.
Selen, tellur och polonium
Selen och tellur är båda relativt sällsynta grundämnen. De hör till de tio nedersta procenten av alla grundämnen när det gäller förekomst. De tenderar att förekomma i jordskorpan i samband med malmer av koppar och andra metaller. Båda erhålls som en biprodukt vid elektrolytisk raffinering av koppar. Under denna process sjunker de till botten av elektrolysetanken, där de kan avlägsnas från det slam som bildas.
Selen förekommer i en mängd olika allotropa former (fysiskt eller kemiskt olika former av samma ämne), varav den vanligaste är ett rött pulver som blir svart när det utsätts för luft. Grundämnets smältpunkt är 217°C (423°F) och dess kokpunkt är 685°C (1 265°F). Tellur är ett silvervitt fast ämne som ser ut som en metall (även om det egentligen är en metalloid). Dess smältpunkt är 450 °C (842 °F) och dess kokpunkt är 990 °C (1 814 °F).
Selen har en intressant roll i levande organismer. Det är viktigt i mycket låga koncentrationer för att upprätthålla hälsan hos de flesta djur. Det tillsätts därför ofta i djurfoder. I högre koncentrationer har dock grundämnet visat sig ha skadliga effekter på djur, vilket orsakar missbildade ungar och sjuka vuxna.
De främsta användningsområdena för selen är elektronik och tillverkning av färgat glas. Fotokopieringsmaskiner, solceller, fotoceller, tv-rör och elektroniska likriktare och reläer (som används för att styra flödet av elektrisk ström) använder alla selen. Några av de vackraste färgade glasen, som sträcker sig från blekrosa till lysande röda, tillverkas med selenföreningar.
Också små mängder tellur används vid tillverkningen av färgat glas. Mer än 90 procent av grundämnet går dock till tillverkning av legeringar av järn och andra metaller.
Polonium har 27 isotoper, som alla är radioaktiva. Det förekommer naturligt i uranmalmer, där det är slutprodukten i den långa serien av reaktioner genom vilka uran genomgår radioaktivt sönderfall. Det är ett av de mest sällsynta grundämnena på jorden, med en förekomst på högst cirka 3 × 10 -10 delar per miljon. Upptäckten av polonium 1898 av den polsk-franska kemisten Marie Curie (1867-1934) är en av de mest dramatiska historierna i vetenskapshistorien. Hon bearbetade tonvis med uranmalm för att få fram några milligram av det nya grundämnet, som hon sedan namngav efter sitt hemland Polen. Polonium har en begränsad användning i mycket specialiserade kraftgenererande apparater, t.ex. de som används för rymdsatelliter och rymdsonder.