UTI – Är traditionell kulturell testning föråldrad?
Publiceringsdatum: Urinvägsinfektioner är den vanligaste typen av bakterieinfektion,1 som står för minst 11 miljoner läkarbesök, 2 till 3 miljoner besök på akutmottagningen, 400 000 sjukhusinläggningar och cirka 2,3 miljarder dollar i sjukvårdskostnader årligen i USA.2,3,4,5
Denna formidabla börda för patienter och hälso- och sjukvårdssystemet fortsätter att växa – till exempel ökar trenderna i befolkningens åldrande och spridningen av antimikrobiellt resistenta bakterier behovet av intensivvård och dödligheten på sjukhus på grund av urinvägsinfektioner.6,7
Dessa faktorer ökar behovet av att diagnostisera urinvägsinfektioner och optimera antimikrobiell behandling på ett effektivt och korrekt sätt. Nya testmetoder och vår nya förståelse av mikrobiomet i urinvägarna väcker dock frågor om relevansen av traditionell urinodling. I den här artikeln går jag igenom de viktigaste typerna av urinvägsinfektioner, nuvarande tillvägagångssätt för användning av urinodling och känslighetstester, nya bevis för urinbiomet, nya kommersiellt tillgängliga tester och framtida tillvägagångssätt för upptäckt av urinvägsinfektioner, inklusive nya biomarkörer och maskininlärningsalgoritmer.
Okomplicerade kontra komplicerade urinvägsinfektioner
Att skilja mellan okomplicerade och komplicerade urinvägsinfektioner är ett viktigt första steg för att vägleda hanteringen. Okomplicerade urinvägsinfektioner är en av de vanligaste typerna av infektioner som behandlas i primärvården. Kvinnor löper störst risk, med en livstidsincidens som närmar sig 50 % och en återfallsfrekvens på cirka 33 %.8
Majoriteten av patienter med okomplicerad urinvägsinfektion är premenopausala kvinnor som inte är gravida och har få eller inga komorbiditeter. Dessa patienter uppvisar vanligtvis symtom på cystit, såsom dysuri, frekvens och trängningar.9 Suprapubisk smärta och hematuri är ovanliga, och pyelonefrit förekommer inte.
Komplicerade urinvägsinfektioner drabbar vanligtvis patienter av båda könen som har strukturella eller funktionella avvikelser i urinvägarna.9 Dessa patienter har ofta genomgått tidigare urologiska ingrepp, nyligen antibiotikaexponering, nyligen eller långvarig kateterisering eller nyligen eller aktuell sjukhusvistelse (sjukhusförvärvade urinvägsinfektioner). Andra högriskgrupper är gravida kvinnor, patienter med diabetes mellitus och patienter med andra immunsupprimerande tillstånd.
Patienter med komplicerade urinvägsinfektioner uppvisar vanligtvis symtom på pyelonefrit, inklusive feber, frossa och flanksmärta, med eller utan illamående. De kan ha en bekräftad eller misstänkt historia av infektion(er) med mer virulenta bakterier. Urinodlingar kan avslöja olika mikrobiota och mönster av antimikrobiell resistens som ligger över genomsnittet. Tyvärr kan båda dessa faktorer undergräva effekten av antimikrobiell behandling.
När man ska överväga urinodling och känslighet
Historiskt sett var den diagnostiska guldstandarden för urinvägsinfektioner att utföra en standardurinodling (det vill säga att sprida 1 mikroliter av urin i mitten av urinströmmen på 5 % fårblod och McConkey-agar och inkubera dem aerobt).1 I detta sammanhang definierades urinvägsinfektion som närvaron av en isolerad, känd uropatogen i en koncentration av >105 CFU/ml eller >102 CFU/ml hos en symtomatisk patient. Med tanke på den höga prevalensen av urinvägsinfektioner och det faktum att en urinodling inte är ett test på plats är det värt att överväga när det är möjligt att avstå från odling utan att äventyra behandlingsresultaten.
I aktuella riktlinjer från Infectious Diseases Society of America (IDSA) rekommenderas inte rutinmässig standardurinodling för patienter som misstänks ha okomplicerade urinvägsinfektioner.10 Det finns betydande bevis för att urinanalys är informativ i denna miljö. I en studie hade cirka 94 % av patienterna med negativ urinanalys också en negativ odling.11 I en longitudinell retrospektiv studie av nästan 21 000 kvinnliga öppenvårdspatienter var en negativ urinanalys förknippad med en 2,5 gånger större sannolikhet för en negativ odling (<103 CFU/ml) jämfört med en positiv urinanalys.12 För patienter med återkommande symtom på urinvägsinfektion var en tidigare negativ urinanalys eller urinodling eller aktuell vaginal irritation eller flytningar förknippade med statistiskt signifikanta ökningar av sannolikheten för en negativ odling.
Leukocytesteras är särskilt informativt vid utvärdering av misstänkta okomplicerade urinvägsinfektioner. I en stor retrospektiv studie av mer än 8 500 sådana patienter förutspådde ett negativt resultat för leukocytesteras ett negativt urinodlingsresultat med 95 % noggrannhet (negativt prediktivt värde, 0,95), medan negativa resultat för både leukocytesteras och nitrat endast var något mer exakta (kombinerat negativt prediktivt värde, 0,96).13 Noterbart är att ett negativt nitratresultat i sig självt var betydligt mindre tillförlitligt för att förutspå ett negativt odlingsresultat (negativt prediktivt värde, 0,87).
För patienter med okomplicerade urinvägsinfektioner rekommenderar IDSA:s riktlinjer att man väljer bland följande läkemedel för empirisk antimikrobiell behandling:10
– Nitrofurantoin 100 mg två gånger dagligen (BID) i 5 dagar
– Trimetoprim/sulfametoxazol (Bactrim DS) i 3 dagar om de lokala resistenssiffrorna är <20 % (om du inte redan har tillgång till dessa uppgifter kan du överväga att kontakta lokala, regionala eller delstatliga hälsovårdsmyndigheter).
– Fosfomycin (engångsdos på 3 gram)
– Observera att fluorokinoloner, t.ex. ciprofloxacin, inte längre rekommenderas för okomplicerade urinvägsinfektioner på grund av höga resistenstal i vissa områden
I övrigt bör valet av antimikrobiell terapi för okomplicerade urinvägsinfektioner styras av lokala mönster av antimikrobiell resistens och klinikerns bästa, informerade gissning om den mest sannolika uropatogenen. I en studie av mer än 9 000 kvinnor med odlingsbekräftade okomplicerade urinvägsinfektioner var 19 % av isolaten resistenta mot trimetoprim-sulfametoxazol och 12 % resistenta mot nitrofurantoin (10 % var resistenta mot ciprofloxacin, som inte längre rekommenderas för empirisk behandling).14 Signifikanta prediktorer för antimikrobiell resistens var bland annat att bo i ett postnummer med högre än genomsnittet av antimikrobiell resistens, att ha en historik av infektion med en resistent uropatogen eller att ha fått antimikrobiell behandling förskriven under de senaste två åren. Baserat på dessa uppgifter utvecklade forskarna en algoritm som valde lämplig antimikrobiell behandling i 92 % av fallen, vilket översteg leverantörens valfrekvens på 87,5 %.
Slutsatsen är att för patienter med okomplicerade urinvägsinfektioner är en traditionell urinodling inte föråldrad, men i de flesta fall är den onödig.
För patienter som misstänks ha komplicerade urinvägsinfektioner bör kliniker välja initial (empirisk) antimikrobiell behandling på grundval av historiska odlings- och känslighetsdata, om de finns tillgängliga, utöver de aktuella resultaten av urinanalysen och lokala mönster av antimikrobiell resistens. Om urinanalysen är negativ och patienten har en tidigare historia av negativa odlingar är sannolikheten 87 % att de nuvarande symtomen inte orsakas av en urinvägsinfektion, enligt färska uppgifter.12 Dessa patienter bör utvärderas för andra orsaker till sina symtom, t.ex. kroniskt bäckensmärtessyndrom (CPPS) eller tumörer i urinvägarna. Om urinanalysen är positiv rekommenderar jag att man behandlar empiriskt och beställer en urinodling och känslighet för att vid behov ändra behandlingen.
Urin är inte sterilt
Till alldeles nyligen var paradigmet för att hantera både okomplicerade och komplicerade infektioner att eliminera mikroorganismer från urinvägarna. Experter inser nu att detta tillvägagångssätt begränsas av två viktiga relaterade faktorer: mikrobiota finns i de asymtomatiska (friska) urinvägarna, och standardodling är relativt okänslig för upptäckt av mikroorganismer i urinvägarna.
Förstärkta och ökande bevis för förekomsten av en diversifierad urinmikrobiom utmanar den gamla kliniska maximen att ”urin är sterilt”.15 I en nyligen genomförd studie utförde forskare kvantitativ PCR av 16S ribosomalt RNA från 16 urinprover från friska män och kvinnor i åldrarna 26 till 90 år.16 Fem prover testades positivt för ett bakteriellt fylum och ett till sex släkten, medan de övriga proverna innehöll i genomsnitt fem fylum och åtta till 36 släkten. I en annan studie utförde forskarna PCR-sekvensering med hög kapacitet av urinprover från åtta kvinnor, som alla hade negativa standardurinodlingar.17 Alla prover var polymikrobiella och uppvisade en avsevärd variabilitet mellan proverna: 45 unika bakteriearter identifierades, varav nio var förknippade med urinvägsinfektioner och 20 var av okänd patogen potential. Liknande studier har bekräftat detta resultat,18 vilket tyder på att urin från friska individer ofta innehåller bakterier som standardurinodlingar inte upptäcker.
En annan studie gick djupare genom att använda förbättrad kvantitativ urinkultur (EQUC) för att avgöra om bakterier som identifierats i urinprover var livskraftiga.19 Denna metod innebär att större volymer urin pläteras, att proverna inkuberas under ett bredare spektrum av tillväxtförhållanden och att man använder längre inkubationsperioder. Bland 65 urinprover som utvärderades med EQUC växte 80 % ut bakterier, varav 92 % inte upptäcktes med standardodling. Hela 35 släkten identifierades, varav Lactobacillus, Corynebacterium, Streptococcus, Actinomyces och Staphylococcus var vanligast. De flesta bakteriearter replikerade sig till ett antal som låg under detektionströskeln för standardprotokoll för urinodling. Dessa resultat bekräftades i en annan nyligen genomförd studie av 150 vuxna (varav hälften rapporterade urinsymtom) där användningen av EQUC påvisade 182 uropatogener – tre gånger fler än vad som påvisades genom standardodling.20
Sammantaget bekräftar resultaten av dessa studier att det finns en diversifierad urinmikrobiota både hos friska individer och hos patienter med urinsymtom och att standardmetoder för urinodling är relativt okänsliga för att karakterisera denna mikrobiom, inklusive uropatogener. Standardodlingar simulerar inte heller på ett tillförlitligt sätt biofilmer, t.ex. sådana som bildas i urinkatetrar, och de slutliga resultaten av standardodlingar och känslighetsanalyser kräver dagar innan de kan rapporteras.11,21 Det är uppenbart att det finns utrymme för förbättringar.
Nya, kommersiellt tillgängliga tester för urinvägsinfektioner
Tre kommersiellt tillgängliga urintester upptäcker uropatogener med högre känslighet än standardurinkultur och screenar också snabbt för bevis på antimikrobiell resistens (tabell 1).18,19,22 Potentiella fördelar med dessa tester är bland annat snabbare identifiering av patogener, mer exakta sensitivitetsresultat och individualiserad behandling, som alla teoretiskt sett kan förbättra patientresultaten.23,24,25
Vikor Urine-ID™-testet är ett PCR-baserat test som kan upptäcka flera bakteriearter och även identifiera upp till 30 bakteriegener som kodar för resistens mot antimikrobiella medel.26 Testresultaten är tillgängliga inom cirka 12 till 24 timmar (tabell 1). Tillsammans med testresultaten ger tillverkaren information om regionala antimikrobiella känslighetsmönster, antibiotikas aktivitetsspektrum, läkemedelskostnader och relevant vägledning från den amerikanska livsmedels- och läkemedelsmyndigheten (FDA).
MicroGenDX UTI Urinalysis Kit är ett test i två steg.27 Först används kvantitativ PCR för att söka efter 16 typer av bakterier samt Candida albicans, med resultat inom 24 timmar. För det andra används nästa generations sekvensering (NGS) för att jämföra mikrobiota-DNA från urinprovet med en databas med mer än 30 000 mikrobiella arter, med resultat inom 3 till 5 dagar (tabell 1). Enligt tillverkaren identifierar UTI Urinalysis Kit alla mikrober i ett urinprov med 99,9 % noggrannhet.
Tabell 1. Översikt över nya kommersiellt tillgängliga tester för urinvägsinfektioner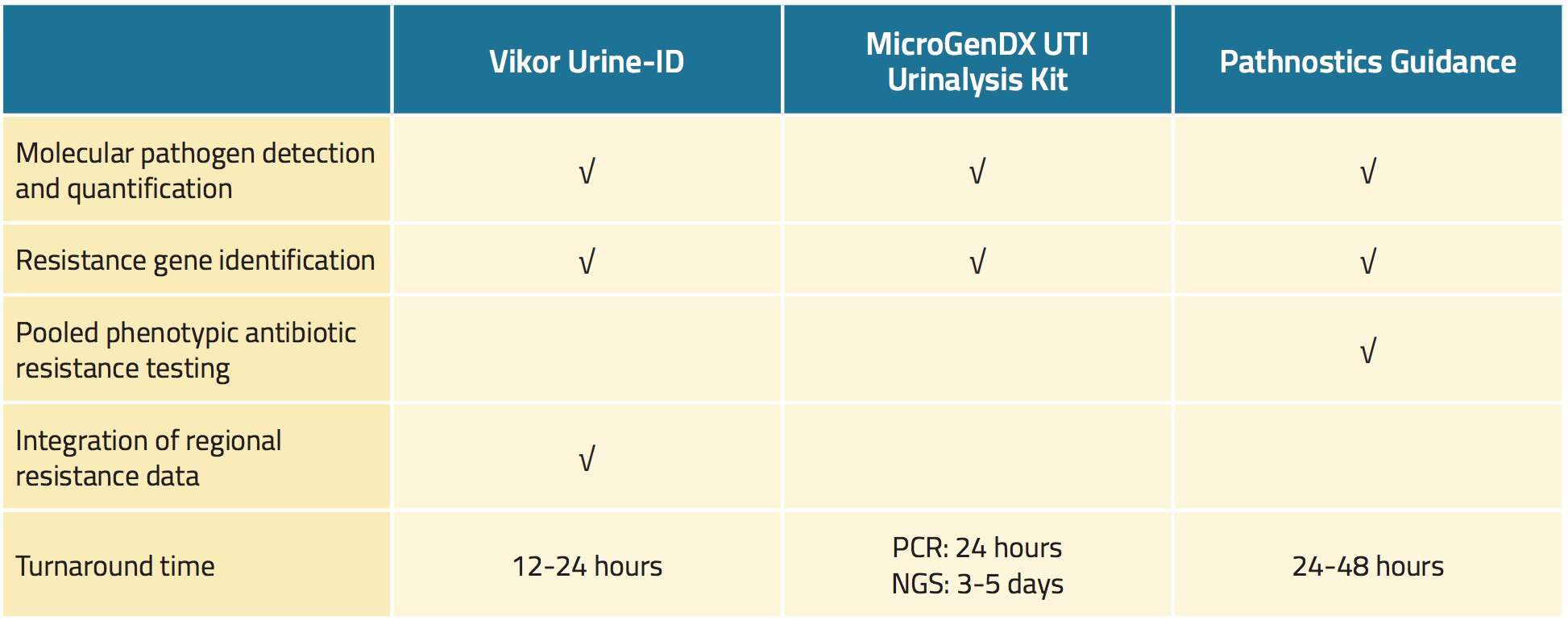
Pathnostics Guidance-assayet består av en serie nya urintester för patienter med prostatit, interstitiell cystit och återkommande urinvägsinfektioner.28 Assayet för urinvägsinfektion använder PCR för att screena för 45 patogener och 38 resistensgener. Pathnostics Guidance-testet genererar också fenotypiska data och sammanslagna resultat för antimikrobiell känslighet. Testet kan använda antingen urinen från urinen från urinen i urinen eller urinen från katetern som kan förvaras i rumstemperatur i upp till fem dagar. Resultaten är tillgängliga inom 24 till 28 timmar.
En invändning bör nämnas. Som vi har diskuterat kan dessa mycket känsliga tester påvisa bakterier i urinen hos asymptomatiska personer och personer vars symtom inte har något samband med urinvägsinfektioner. Kliniker bör därför inte basera sina behandlingsbeslut enbart på testresultaten. Att göra det kan få negativa konsekvenser för patienterna. I en studie av 673 unga och medelålders kvinnor med asymtomatisk bakteriuri och en historia av återkommande urinvägsinfektioner fick hälften av patienterna antimikrobiell behandling medan resten inte fick någon behandling.22 Vid uppföljning efter 6 och 12 månader var antimikrobiell behandling förknippad med statistiskt signifikanta ökningar av återkommande urinvägssymtom. För att undvika överanvändning av antimikrobiella medel med tillhörande biverkningar, kostnader och selektion för antimikrobiell resistens är det viktigt att kliniker utvärderar testresultaten mot bakgrund av patienternas totala risk och historia av urinvägsinfektioner och aktuella kliniska presentation.
Framtida riktningar för urinbaserade tester
Även när nyligen godkända tester är redo att avsevärt förbättra upptäckten och hanteringen av urinvägsinfektioner jämfört med enbart standardodling, fortsätter forskarna att söka efter sätt att förbättra diagnos, patogenupptäckt, kvantifiering av antimikrobiell känslighet och behandlingsalgoritmer. Exempel på detta är användning av tekniker för maskininlärning, sammansatta analyser av nya biomarkörer och tester för cellulära proteinsignaturer.
Maskininlärningsalgoritmer har tidigt visat sig lovande när det gäller att förbättra upptäckt och utvärdering av patienter med okomplicerade urinvägsinfektioner. I en studie utvärderades till exempel 17 kliniska variabler och 42 immunologiska variabler för att identifiera de bästa prediktorerna för resultaten av urinodling. Grumlighet i urinen (turbiditet) var den bästa kliniska prediktoren, med ett positivt prediktivt värde på 0,65 (vilket innebär att närvaron av turbiditet i urinen identifierade ett odlingspositivt prov med 65 % noggrannhet) och ett negativt prediktivt värde på 0.79 (vilket innebär att avsaknaden av turbiditet i urinen identifierade ett odlingsnegativt prov med 79 procents noggrannhet).29 Turbiditet i urinen var alltså relativt okänslig men uppvisade en rimlig specificitet för att upptäcka ett odlingspositivt prov. Tillsammans uppnådde fyra urinbiomarkörer – matrismetallopeptidas 9, neutrophil gelatinase-associated lipocalin, interleukin (IL)-8 och IL-1β – ett betydligt högre positivt prediktivt värde på 0,82 och ett jämförbart negativt prediktivt värde på 0,76. Även om kombinationen av dessa fyra urinbiomarkörer med urintröghet inte förbättrade dessa prediktiva värden ytterligare, visade studiens resultat att maskininlärningsalgoritmer på ett tillförlitligt sätt kan identifiera de flesta patienter med okomplicerade urinvägsinfektioner.29
När maskininlärningsmodellerna förfinas kan deras prediktiva värden förbättras, vilket skulle kunna förbättra diagnosen och behandlingen av urinvägsinfektioner i utsatta befolkningsgrupper ytterligare, samtidigt som den diagnostiska arbetsbördan minskas. I en nyligen genomförd stor studie analyserades till exempel mer än 212 000 rapporter om mikroskopi-, odlings- och känslighetsresultat för urin från tre sjukhus och öppenvårdstjänster i Storbritannien.30 Särskilda maskininlärningsalgoritmer utformades för undergrupper med hög risk, till exempel gravida kvinnor, barn och personer med ihållande eller återkommande urinvägsinfektioner. Maskininlärning upptäckte cirka 95 % av kulturpositiva prover samtidigt som arbetsbelastningen i samband med urinodling minskade med cirka 41 % och uppnådde cirka 24 % högre specificitet än en heuristisk modell baserad på antalet vita blodkroppar och bakterier. Dessa resultat är särskilt anmärkningsvärda i en tid då befolkningens åldrande och uppkomsten av antimikrobiellt resistenta bakterier ökar behovet av att effektivt och noggrant upptäcka urinvägsinfektioner som kräver behandling.
Recidiverande urinvägsinfektioner (historiskt definierat som minst två urinvägsinfektioner under de senaste sex månaderna eller mer än tre infektioner under det senaste året) har visat sig drabba cirka 50 % bland kvinnor över 55 år och 27 % av yngre kvinnor31 , 32 Enligt nuvarande riktlinjer krävs intensiv behandling med åtgärder som profylaktisk antimikrobiell behandling, begränsning av användningen av spermiedödande medel, tömning efter samlag, immunoaktiv profylax med OM-89, vaginal vaccinering med Urovac och användning av vaginala östrogenkrämer eller östrogenringar hos kvinnor efter förlossningen31 , 33 Analyser av serum- och urinbiomarkörer kan hjälpa till att bättre förutsäga vilka patienter som kommer att utveckla återkommande urinvägsinfektioner så att de får tidigare, riktade insatser.32 Relevanta biomarkörer för återkommande urinvägsinfektioner är bland annat minskade serumnivåer av D-vitamin och prostataspecifikt antigen, ökade serumnivåer av immunoglobuliner, granulocytkolonistimulerande faktor, makrofagkolonistimulerande faktor och IL-5, medan relevanta urinbiomarkörer är förhöjda nivåer av IL-8 och minskade nivåer av nervtillväxtfaktor och neutrofil gelatinase-associerat lipocalin.
Framtida diagnostik kan också omfatta biomarköranalyser på plats som kompletterar eller minskar behovet av urinodlingar. Ett idealiskt test skulle vara lika snabbt och billigt som ett urinprov, men mer exakt och noggrant. Potentiella kandidater är trimetylamin och acetat, som är markörer för bakteriell metabolism, samt xantinoxidas och myeloperoxidas, som är enzymatiska biomarkörer.34
Framtida tester skulle också kunna utvärdera exosomen i urinen som en potentiell biomarkör för urinvägsinfektioner. Exosomen består av små extracellulära vesiklar som transporterar cellulära proteiner. I en studie var urinproteinerna Akt (ett intracellulärt signalprotein) och CD9 (ett intracellulärt transmembranprotein) signifikant förhöjda hos kvinnor med urinvägsinfektioner jämfört med kvinnor med asymtomatisk bakteriuri, och nivåerna av båda proteinerna minskade signifikant efter antimikrobiell behandling35 . Resultaten av sådana studier skulle en dag kunna underlätta utvecklingen av kommersiella analyser som utvärderar exosomen i urinvägarna för att hjälpa till att vägleda behandlingsbeslut.
Sammanfattning
Utvärderingen och hanteringen av urinvägsinfektioner är en integrerad del av urologipraktiken. Vid okomplicerade urinvägsinfektioner är urinodling vanligen onödig och empirisk behandling enligt gällande IDSA-riktlinjer är lämplig. Empirisk behandling baserad på historiska odlings- och känslighetsresultat är också lämplig för komplicerade urinvägsinfektioner, men bör modifieras baserat på aktuell odling och känslighet. Återkommande urinvägsinfektioner kan motivera intensiva terapeutiska och beteendemässiga insatser. ven om detta är vår nuvarande bästa praxis lämnar de stort utrymme för förbättringar, särskilt med tanke på de senaste bevisen för att det finns ett mikrobiom i urinvägarna och begränsningarna för standardscreening och odling. Det finns ett behov av snabba, tillförlitliga tester för att bättre upptäcka uropatogener, skilja kliniskt betydelsefull urindysbios från kliniskt inkonsekvent bakteriuri och vägleda antimikrobiell behandling baserat på personliga resistensdata. Känslighetsanalyser baserade på kvantitativ PCR och nästa generations sekvensering finns nu tillgängliga. I framtiden kan användningen av förbättrade kvantitativa urinodlingsmetoder också förbättra den kliniska vården. Forskarna utvärderar också algoritmer för maskininlärning som innehåller serum- och urinbiomarkörer och andra kliniska variabler för att effektivare upptäcka urinvägsinfektioner, förutsäga återfall och minska den diagnostiska arbetsbördan. Genom att integrera dessa nya metoder med uppgifter om lokal resistens och återinläggning på sjukhus kan man öka deras användbarhet. Slutmålet är att utveckla känsliga, specifika, kostnadseffektiva tester och praktiska algoritmer som förbättrar hanteringen och patientresultaten.
Skrivet av: Edward Schaeffer, MD, Ph.D., ordförande, avdelningen för urologi, Feinberg School of Medicine, programchef, Genitourinary Oncology Program, Robert H. Lurie Comprehensive Cancer Center, Northwestern University, Chicago, Illinois
1. Schaeffer, AJ., Matulewicz, RS., & Klumpp, DJ. (2016). Infektioner i urinvägarna. I AJ. Wein, & et al (Eds.), Campbell-Walsh Urology, Eleventh Edition Philadelphia: Elsevier-Saunders.
2. Schappert, S. M. och E. A. Rechtsteiner. ”Uppskattningar av användningen av ambulanssjukvård för 2007”. Vital and Health Statistics. Series 13, Data from the National Health Survey 169 (2011): 1-38.
3. Foxman, Betsy. ”Urinvägsinfektionssyndrom: förekomst, återkomst, bakteriologi, riskfaktorer och sjukdomsbörda”. Infectious disease clinics of North America 28, nr 1 (2013): 1-13.
4. Foxman, Betsy. ”Epidemiologi för urinvägsinfektioner”. Nature Reviews Urology 7, nr 12 (2010): 653.
5. Simmering, Jacob E., Fan Tang, Joseph E. Cavanaugh, Linnea A. Polgreen och Philip M. Polgreen. ”Ökningen av sjukhusinläggningar för urinvägsinfektioner och tillhörande kostnader i USA, 1998-2011”. I Open forum infectious diseases, vol. 4, no. 1. Oxford University Press, 2017.
6. Nguyen, Hoa Q., Nga TQ Nguyen, Carmel M. Hughes och Ciaran O’Neill. ”Trender och inverkan av antimikrobiell resistens på äldre inneliggande patienter med urinvägsinfektioner (UTI): En nationell retrospektiv observationsstudie.” PloS one 14, no. 10 (2019).
7. Critchley, Ian A., Nicole Cotroneo, Michael J. Pucci och Rodrigo Mendes. ”Belastningen av antimikrobiell resistens bland urinvägsisolat av Escherichia coli i USA 2017”. PloS one 14, no. 12 (2019).
8.Gupta, Kalpana och Barbara W. Trautner. ”Diagnostik och behandling av återkommande urinvägsinfektioner hos icke-gravida kvinnor”. Bmj 346 (2013): f3140.
9. Tan, Chee Wei och Maciej Piotr Chlebicki. ”Urinvägsinfektioner hos vuxna”. Singapore medical journal 57, nr 9 (2016): 485.
10. Gupta, Kalpana, Thomas M. Hooton, Kurt G. Naber, Björn Wullt, Richard Colgan, Loren G. Miller, Gregory J. Moran et al. ”International clinical practice guidelines for the treatment of acute uncomplicated cystitis and pyelonephritis in women: a 2010 update by the Infectious Diseases Society of America and the European Society for Microbiology and Infectious Diseases”. Clinical infectious diseases 52, no. 5 (2011): e103-e120.
11. Huang, Bin, Lei Zhang, Weizheng Zhang, Kang Liao, Shihong Zhang, Zhiquan Zhang, Xingyan Ma et al. ”Direkt detektion och identifiering av bakteriella patogener från urin med optimerad provhantering och förbättrad testalgoritm”. Journal of clinical microbiology 55, no. 5 (2017): 1488-1495.
12. Cohen, Jason E., Emily M. Yura, Liqi Chen och Anthony J. Schaeffer. ”Predictive Utility of Prior Negative Urine Cultures in Women with Suspected Recurrent Uncomplicated Urinary Tract Infections”. The Journal of urology 202, no. 5 (2019): 979-985.
13. Marques, Alexandre Gimenes, Jacyr Pasternak, Márcio dos Santos Damascena, Carolina Nunes França och Marinês Dalla Valle Martino. ”Prestanda för screeningprov med dipstick som en prediktor för negativ urinodling”. Einstein (São Paulo) 15, nr 1 (2017): 34-39.
14. Cohen, Jason E., Liqi Chen och Anthony J. Schaeffer. ”Algoritmer som använder tidigare resistens, tidigare antimikrobiella förskrivningar och patientens bostadsort förbättrar empirisk terapi för kvinnor med okomplicerade urinvägsinfektioner”. Urology 137 (2020): 72-78.
15. Finucane, Thomas E. ”’Urinvägsinfektion’ och mikrobiomet.” The American journal of medicine 130, no. 3 (2017): e97-e98.
16. Lewis, Debbie Ann, Richard Brown, Jon Williams, Paul White, Susan Kim Jacobson, Julian Marchesi och Marcus John Drake. ”The human urinary microbiome; bacterial DNA in voided urine of asymptomatic adults”. Frontiers in cellular and infection microbiology 3 (2013): 41.
17. Siddiqui, Huma, Alexander J. Nederbragt, Karin Lagesen, Stig L. Jeansson och Kjetill S. Jakobsen. ”Assessing diversity of the female urine microbiota by high throughput sequencing of 16S rDNA amplicons”. BMC microbiology 11, nr 1 (2011): 244.
18. Wolfe, Alan J., Evelyn Toh, Noriko Shibata, Ruichen Rong, Kimberly Kenton, MaryPat FitzGerald, Elizabeth R. Mueller et al. ”Evidence of uncultivated bacteria in the adult female bladder”. Journal of clinical microbiology 50, no. 4 (2012): 1376-1383.
19. Hilt, Evann E., Kathleen McKinley, Meghan M. Pearce, Amy B. Rosenfeld, Michael J. Zilliox, Elizabeth R. Mueller, Linda Brubaker, Xiaowu Gai, Alan J. Wolfe och Paul C. Schreckenberger. ”Urin är inte sterilt: användning av förbättrade urinkulturtekniker för att upptäcka den bofasta bakteriefloran i den vuxna kvinnans urinblåsa”. Journal of clinical microbiology 52, no. 3 (2014): 871-876.
20. Price, Travis K., Tanaka Dune, Evann E. Hilt, Krystal J. Thomas-White, Stephanie Kliethermes, Cynthia Brincat, Linda Brubaker, Alan J. Wolfe, Elizabeth R. Mueller och Paul C. Schreckenberger. ”Den kliniska urinodlingen: förbättrade tekniker förbättrar upptäckten av kliniskt relevanta mikroorganismer”. Journal of clinical microbiology 54, no. 5 (2016): 1216-1222.
21. Sathiananthamoorthy, Sanchutha, James Malone-Lee, Kiren Gill, Anna Tymon, Trang K. Nguyen, Shradha Gurung, Linda Collins et al. ”Reassessment of routine midstream culture in diagnosis of urinary tract infection”. Journal of clinical microbiology 57, no. 3 (2019): e01452-18.
22. Cai, Tommaso, Sandra Mazzoli, Nicola Mondaini, Francesca Meacci, Gabriella Nesi, Carolina D’Elia, Gianni Malossini, Vieri Boddi och Riccardo Bartoletti. ”Rollen av asymtomatisk bakteriuri hos unga kvinnor med återkommande urinvägsinfektioner: att behandla eller inte behandla?”. Clinical infectious diseases 55, no. 6 (2012): 771-777.
23. Lehmann, Lutz E., Stefan Hauser, Thomas Malinka, Sven Klaschik, Stefan U. Weber, Jens-Christian Schewe, Frank Stüber och Malte Book. ”Snabb kvalitativ identifiering av patogener för urinvägsinfektioner med SeptiFast® realtids-PCR”. PLoS One 6, nr 2 (2011).
24. Schmidt, K., K. K. Stanley, R. Hale, L. Smith, J. Wain, J. O’grady och D. M. Livermore. ”Utvärdering av multiplex tandem PCR (MT-PCR)-analyser för upptäckt av bakteriella resistensgener bland Enterobacteriaceae i kliniska uriner”. Journal of Antimicrobial Chemotherapy 74, no. 2 (2019): 349-356.
25. Barczak, Amy K., James E. Gomez, Benjamin B. Kaufmann, Ella R. Hinson, Lisa Cosimi, Mark L. Borowsky, Andrew B. Onderdonk et al. ”RNA-signaturer möjliggör snabb identifiering av patogener och antibiotikakänslighet”. Proceedings of the national academy of sciences 109, no. 16 (2012): 6217-6222.
26. Urine-IDTM – Vikor Scientific. https://www.vikorscientific.com/test-menu/urine-id/. Tillgänglig den 15 februari 2020.
27. UTI Urine Kit – Försäkring | MicroGen Diagnostics. https://microgendx.com/product/urine-kit-ins/. Tillgänglig den 15 februari 2020.
28. Vägledning – Pathnostics. https://www.pathnostics.com/physicians/tests/guidance/. Tillgänglig den 15 februari 2020.
29. Gadalla, Amal AH, Ida M. Friberg, Ann Kift-Morgan, Jingjing Zhang, Matthias Eberl, Nicholas Topley, Ian Weeks et al. ”Identification of clinical and urine biomarkers for uncomplicated urinary tract infection using machine learning algorithms”. Scientific Reports 9, nr 1 (2019): 1-11.
30. Burton, Ross J., Mahableshwar Albur, Matthias Eberl och Simone M. Cuff. ”Användning av artificiell intelligens för att minska den diagnostiska arbetsbelastningen utan att äventyra upptäckten av urinvägsinfektioner”. BMC medical informatics and decision making 19, no. 1 (2019): 171.
31. Bonkat, G., R. Pickard, R. Bartoletti, F. Bruyere, S. E. Geerlings och F. Wagenlehner. ”Riktlinjer för urologiska infektioner. EAU:s riktlinjer.” European Association of Urology (2017).
32. Jhang, Jia-Fong och Hann-Chorng Kuo. ”Nya framsteg inom återkommande urinvägsinfektioner från patogenes och biomarkörer till prevention”. Tzu-Chi Medical Journal 29, no. 3 (2017): 131.
33. Dason, Shawn, Jeyapandy T. Dason och Anil Kapoor. ”Riktlinjer för diagnos och behandling av återkommande urinvägsinfektioner hos kvinnor”. Canadian Urological Association Journal 5, nr. 5 (2011): 316.
34. Karlsen, H. och T. Dong. ”Biomarkörer för urinvägsinfektioner: aktuell kunskap och lovande tillämpningar för snabba kemiska sensorer på remsor”. Analytical Methods 7, nr 19 (2015): 7961-7975.
35. Mizutani, Kosuke, Kyojiro Kawakami, Kengo Horie, Yasunori Fujita, Koji Kameyama, Taku Kato, Keita Nakane et al. ”Urinary exosome as a potential biomarker for urinary tract infection”. Cellular microbiology 21, no. 7 (2019): e13020.
Relaterat innehåll:
Download: Det är en av de viktigaste frågorna för att få en bra information: Volym 5, nummer 1