Vetenskapliga projekt för nybörjare: Kemi
Kemi
Salt eller socker:
Lösningar är inget annat än blandningar av olika föreningar eller beståndsdelar. Du möter lösningar varje dag utan att du ens inser det.
Även luften du andas?som innehåller vatten?är en lösning av en vätska och en gas. Om du drack en läsk i dag drack du faktiskt en lösning av en gas löst i smaksatt vatten. Om du bär ett armband av sterling silver bär du en lösning av två metaller.
I det här experimentet kommer du att arbeta med en flytande lösning, som är en av tre typer av lösningar. De andra typerna är gasformiga lösningar och fasta lösningar.
Så vad verkar vara problemet?
En lösta substans är det ämne?antingen ett fast ämne, en vätska eller en gas?som löses upp. Ett lösningsmedel, som också kan vara ett fast ämne, en vätska eller en gas, är det ämne som löser upplösningen. En lösning är en enhetlig blandning av en lösta substans (vanligtvis ett fast ämne) som löses upp i ett lösningsmedel (vanligtvis en vätska).
När du rör om en sked socker i ett glas vatten bildar du en lösning. Denna typ av flytande lösning består av en fast lösta substans, som är sockret, och ett flytande lösningsmedel, som är vattnet. När sockermolekylerna sprids jämnt i vattnet löses sockret upp.
Men om man blandar en vätska i en gas bildar man en annan typ av lösning, en så kallad gasformig lösning. Ett exempel på denna typ av lösning är fukt. Fukt är vatten (en vätska) upplöst i luft (en gas).
Tänk på hur en sockerbit löser sig i vatten, jämfört med en förpackning med löst socker. Kuben löser sig långsammare eftersom färre sockermolekyler initialt är i kontakt med vattnet.
I en fast lösning, t.ex. sterlingsilver, blandas koppar som har värmts upp vid höga temperaturer med silver som också har värmts upp tills det smälter. Kopparn är den lösta substansen, dvs. det ämne som kommer att lösas upp i lösningsmedlet. Silvret är lösningsmedlet.
Typen av lösning bestäms av lösningsmedlets materiatillstånd. Om ämnet som löser upp är en vätska kallas lösningen för en flytande lösning. Om lösningsmedlet är en gas kallas lösningen för en gasformig lösning. Och du gissade rätt: Ett fast lösningsmedel bildar en fast lösning.
Du kan kontrollera storleken på salt- och sockerkristaller i ett mikroskop eller ett förstoringsglas, vilket gör det möjligt för dig att se deras former också. Om du ritar vad du ser, med hjälp av en penna så att du kan illustrera skuggning, kan du inkludera illustrationen som en del av den slutliga visningen av ditt science fair-projekt.
Det finns några faktorer som generellt sett ökar mängden lösta ämnen som kan lösas upp. Om du till exempel vill lösa upp mer socker i samma mängd vatten kan du värma vattnet. Du kan också mala sockret till mindre partiklar för att öka dess yta, eller så kan du röra om blandningen.
Under de år som du har använt salt och socker på dina livsmedel har du förmodligen märkt att varje bit salt?som faktiskt är en kristall?är lite mindre än varje sockerbit, som också är en kristall.
En molekyl är två eller flera grundämnen som är kemiskt kombinerade. En saltmolekyl innehåller natrium och klor, som kombineras kemiskt till natriumklorid. Den kemiska formeln för detta salt är NaCl. En molekyl av socker innehåller kol, väte och syre. Den kemiska formeln för socker är C12H22O11.
Problemet som du ska försöka lösa i det här experimentet är om socker eller salt löser sig snabbare när det blandas i olika vätskor. Påverkar storleken på bitarna hur snabbt de blandas med vätskan?
När du löser socker eller salt i en vätska?låt oss säga vatten?Det som händer är att sockermolekylerna flyttar sig för att passa in mellan vattenmolekylerna i ett glas eller en bägare. Illustrationen nedan visar hur de olika molekylerna är placerade i behållaren.
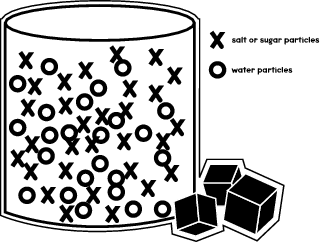
I ditt experiment kommer du att se hur salt- och sockermolekyler rör sig i olika vätskor och löser upp sig med olika hastighet.
Teckningen på detta avsnitt, ?Salt eller socker: Vilken löser sig snabbare i olika vätskor?” kan användas som titel för ditt projekt om du vill. Du kan också överväga en av följande titlar för ditt projekt:
- Den stora upplösningstävlingen mellan salt och socker
- Användning av salt och socker för att utforska hur ämnen löser sig
Det går bra att välja vilket namn du vill. Låt oss nu ta en minut för att fundera på varför detta projekt är en värdefull användning av din tid.
Vad är poängen?
När det finns gott om utrymme mellan molekylerna i ett lösningsmedel sägs lösningsmedlet vara omättat. När mycket lösningsmedel har lösts upp i lösningsmedlet, men det fortfarande finns lite utrymme mellan molekylerna, är lösningen koncentrerad. När absolut ingen mer lösta substans kan lösas upp i ett lösningsmedel är lösningen mättad.
Och när den överflödiga lösta substansen har lösts upp genom upphettning av lösningen sägs den vara övermättad.
Syftet med det här experimentet, förutom att lära sig om salt eller socker löser sig snabbare i olika vätskor, är att lära sig hur molekyler interagerar i en lösning.
Som du såg i den föregående illustrationen tar vattenmolekylerna upp det mesta av utrymmet i behållaren. Men det finns fortfarande en del tillgängligt utrymme där socker- eller saltmolekylerna kan få plats. Genom ditt experiment kommer du att lära dig hur snabbt sockermolekylerna passar in i dessa utrymmen, jämfört med saltpartiklarna.
Om du vet detta kan du bättre förstå den process som sker när ett ämne löses upp.
Kontrollen i ditt experiment kommer att vara vatten. De andra vätskorna som du löser salt och socker i kommer att vara variablerna.
| Kontroller: | Lösningsmedel?vatten | |
| Lösningsmedel?socker, salt | ||
| Variabler: | Fem olika klara vätskor (kan vara färgade) |
Håll i minnet när du utför ditt experiment att det är mycket viktigt att vätskorna du använder har samma temperatur. Du har redan lärt dig att socker löser sig snabbare i en varm vätska än i en kall, så du vet att det inte skulle bli ett korrekt experiment om en del av de vätskor du använder är varma och en del kalla. Vätskans temperatur skulle bli en variabel.
Det är därför viktigt att alla vätskor du använder, inklusive vatten, har rumstemperatur. Om du normalt sett förvarar dem i kylskåpet ska du se till att låta dem stå ute på bänken över natten tills alla har samma temperatur.
För att ge dig lite mer flexibilitet när du genomför experimentet kan du välja de vätskor i vilka du ska lösa socker och salt. Det är ingen idé att gå ut och köpa ytterligare vätskor om du redan har det du behöver.
Förutsätt inte att vätskor som har stått på olika ställen i ditt hus har samma temperatur. En flaska läsk som har stått i garaget kan till exempel vara flera grader kallare än alkohol från badrumsskåpet eller äppeljuice från kökets skafferi. Se till att alla vätskor står på samma plats för att de ska uppnå samma rumstemperatur. If you don’t, the results of your experiment won’t be valid.
Just make sure you choose liquids that are different from each other in taste, color, odor, and purpose. You’ll also need to select those that allow you to observe the salt and sugar as it dissolves. If you use milk or orange juice, for example, you won’t be able to watch the salt and sugar dissolve. Some suggestions for liquids to consider are:
- White vinegar
- Club soda
- Ginger ale
- Glass cleaner (such as Windex)
- Lemonade
- Tea or iced tea (each at room temperature)
- Apple juice
- Rubbing alcohol
All of these are commonly found around the house, perhaps saving you a trip to the store.
What Do You Think Will Happen?
Nu när du vet hur lösningar bildas och några av de faktorer som kommer att påverka hastigheten med vilken sockret och saltet som du kommer att använda kommer att lösas upp, bör du kunna göra en bra gissning om vilken av dem som kommer att lösas upp snabbare.
Om du inte har gjort det här försöket tidigare vet du inte om vätskorna du använder kommer att vara en faktor när det gäller upplösning av salt och socker. Detta gör det svårare att bilda en hypotes, men oroa dig inte. Om din hypotes visar sig vara korrekt eller inte påverkar inte giltigheten eller resultatet av ditt experiment.
Och även om du inte kommer att veta förrän efter ditt experiment om egenskaperna hos de olika vätskorna du väljer kommer att påverka hastigheten med vilken saltet och sockret löses upp, vet du att saltkristaller i allmänhet är mindre än sockerkristaller. Och du vet att vätskornas temperatur inte kommer att vara en faktor i ditt experiment.
Sök bara att använda dina tidigare erfarenheter, den information du har läst tidigare i det här avsnittet och ditt sunda förnuft för att komma fram till en bra hypotes.
Håll i minnet att din hypotes måste formuleras som en objektiv mening, inte som en fråga. Så gå vidare och gissa om saltet eller sockret löser sig snabbare, och låt oss börja med experimentet.
Material som du behöver för det här projektet
Vissa vinäger, klubbsoda, ginger ale, glasrengöringsmedel, sprit, äppeljuice, lemonad och te är några av de vätskor som föreslås för användning i det här experimentet. Om du vill ersätta en eller flera av de föreslagna vätskorna med en annan vätska går det bra. Se bara till att alla vätskor är klara och har rumstemperatur.
Mängderna material som anges nedan är tillräckliga för att du ska kunna genomföra experimentet tre gånger med varje vätska. You’ll need:
- 12 clear, plastic cups (10 ounce )
- One permanent marker
- One (1 teaspoon) (5.0 ml) measuring spoon
- One (12 teaspoon) (2.5 ml) measuring spoon
- One (1 cup) (240 ml) measuring cup
- 8 teaspoons (40 ml) salt, divided in 16 (12 teaspoon) portions
- 8 teaspoons (40 ml) sugar, divided in 16 (12 teaspoon) portions
- 48 ounces (1,440 ml) water at room temperature
- 24 ounces (720 ml) each of five different, clear liquids, all at room temperature
- One clock or watch with a second hand
- One clear plastic cup containing eight fluid ounces (240 ml) water at room temperature
Remember to make sure that all liquids are at room temperature.
Conducting Your Experiment
When you’ve gathered all your materials, you’ll be ready to begin your experiment. Följ bara dessa steg:
Håll en kopp med vanligt vatten inom synhåll så att du kan jämföra den med kopparna som innehåller salt och socker. Det blir intressant att se hur vätskornas utseende förändras när saltet och sockret löses upp.
Det kommer att ta en liten stund för sockret och saltet att lösas upp. För bästa resultat ska du inte röra om i lösningarna, eftersom det ger ytterligare en variabel. Om du måste röra om, rör då om varje lösning tre gånger och sluta sedan. Rör inte om förrän du märker att det finns lösningsmedel i botten av var och en av de två behållarna. Om du rör om lösningarna ojämnt kommer ditt experiment att vara ogiltigt.
- Skriv ”salt” på sex av plastmuggarna och ”socker” på de andra sex med hjälp av en permanentpenna.
- Lägg 1/2 tesked (2,5 ml) salt i var och en av de sex muggarna som är märkta ?salt.
- Lägg 1/2 tesked (2,5 ml) socker i var och en av de sex muggarna som är märkta ?socker?
- Tillsätt 8 ounces (240 ml) vatten till en kopp med salt och en kopp med socker. Anteckna genast den tid då vattnet tillsattes på ett datagram som liknar det som visas i nästa avsnitt, ”Håll koll på ditt experiment”.
- Observera att de lösta ämnena (salt och socker) löser sig i lösningsmedlet (vatten). Anteckna på datagrammet den tid då det verkar som om varje lösta substans har lösts upp fullständigt. Dessa tider kommer förmodligen inte att vara desamma.
- Beräkna den förflutna tiden under vilken upplösningen skedde. Ta den tid då vattnet tillsattes i kopparna och upplösningen började, och subtrahera den från den tid då upplösningen avslutades. Detta ger dig de totala minuterna som det tog för saltet och sockret att helt lösa upp sig i vätskan.
- Upprepa steg 4 till 6 och använd varje annan vätska i stället för vatten.
- Tvätta, skölj och torka noggrant var och en av de 12 kopparna.
- Upprepa steg 2 till 8 ytterligare två gånger, för totalt tre försök för var och en av de sex vätskorna.
- Beräkna en genomsnittlig upplösningstid för saltet och sockret i var och en av de sex vätskorna.
Håll i minnet att för att få fram den genomsnittliga tiden som det tog för saltet och sockret att lösa upp sig i varje vätska adderar du de tre tider som registrerats för varje vätska och delar dem sedan med tre. Siffran du får när du delar tiderna är medeltiden.
Hålla reda på ditt experiment
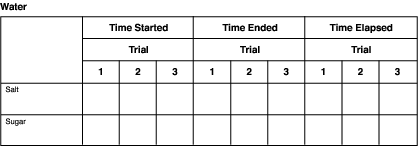
Diagram som följande kan användas för att registrera information för varje lösningsmedel. Det är bara att ändra namnen på lösningsmedlen i rubriken.
Se till att registrera tiderna allt eftersom. Förlita dig inte på ditt minne för att skriva ner dem senare. Du kommer att ha många siffror när du avslutar experimentet.
Sätt ihop allt
Vad märkte du om hur snabbt saltet och sockret löstes upp? Bevisade du att din hypotes var korrekt? Eller felaktig? Kunde du upptäcka någon typ av mönster när du tillsatte salt och socker till de olika vätskorna? Var det uppenbart att saltet löste sig bättre och snabbare i vissa vätskor jämfört med sockret? Kan du komma på några orsaker till varför detta kan ha inträffat?
Tror du att den kemiska naturen hos lösningsmedlet och lösningsmedlet påverkade upplösningshastigheten? Använd den information du samlade in när du undersökte ditt ämne för att hjälpa dig att besvara dessa frågor.
Desto mer du vet om ditt projekt, desto bättre kan du analysera dina data korrekt och komma fram till en bra slutsats.
Fortsatt undersökning
Som tidigare nämnts är de faktorer som påverkar lösligheten hos fasta lösningsmedel följande:
- Höjning eller sänkning av lösningsmedlets temperatur
- Höjning av lösningsmedlets yta
- Rörning
Om du vill ta det här projektet ett eller två steg längre kan du utforma ett experiment som testar en?
Du skulle enkelt kunna jämföra hastigheten med vilken sockerbitar löses upp i vätska med hastigheten med vilken granulerat socker löses upp.
Och du skulle kunna använda samma lösta ämne, till exempel socker, och testa om omrörning av lösningen gör att den löses upp snabbare. Uppvärmning och nedkylning av lösningsmedlet samtidigt som du tillsätter samma lösta ämne skulle också vara en möjlighet till ytterligare experiment.
Om du är nyfiken och villig att experimentera kan du förmodligen komma på många varianter för det här projektet. Och eftersom experimentet endast kräver vanliga och billiga material bör du kunna experimentera så mycket du vill.
Utdrag ur The Complete Idiot’s Guide to Science Fair Projects 2003 av Nancy K. O’Leary och Susan Shelly. Alla rättigheter förbehålls, inklusive rätten att återge hela eller delar av materialet i någon form. Används efter överenskommelse med Alpha Books, en medlem av Penguin Group (USA) Inc.
För att beställa denna bok direkt från förlaget, besök Penguin USA:s webbplats eller ring 1-800-253-6476. Du kan också köpa den här boken på Amazon.com och Barnes & Noble.