UTI – Is de traditionele kweektest achterhaald?
Gepubliceerde datum: Maart 2020
Infecties van de urinewegen zijn de meest voorkomende bacteriële infectie,1 verantwoordelijk voor ten minste 11 miljoen bezoeken aan de huisarts, 2 tot 3 miljoen bezoeken aan de afdeling spoedeisende hulp, 400.000 ziekenhuisopnames en ongeveer 2,3 miljard dollar aan gezondheidszorgkosten per jaar in de Verenigde Staten.2,3,4,5
Deze enorme belasting voor patiënten en de gezondheidszorg neemt nog steeds toe – de vergrijzing van de bevolking en de verspreiding van bacteriën die resistent zijn tegen antimicrobiële middelen vergroten bijvoorbeeld de behoefte aan intensieve zorg en de sterfte in het ziekenhuis als gevolg van urineweginfecties.6,7
Dergelijke factoren vergroten de noodzaak om urineweginfecties te diagnosticeren en de antimicrobiële therapie efficiënt en accuraat te optimaliseren. Nieuwe testmethoden en een steeds beter begrip van het microbioom in de urine roepen echter vragen op over de relevantie van de traditionele urinekweek. In dit artikel geef ik een overzicht van de belangrijkste soorten urineweginfecties, de huidige benaderingen van het gebruik van urinekweek en gevoeligheidstests, recent bewijs voor het microbioom in de urine, nieuwe commercieel beschikbare tests en toekomstige benaderingen voor de detectie van urineweginfecties, waaronder nieuwe biomarkers en algoritmen voor machinaal leren.
Ongecompliceerde versus gecompliceerde urineweginfecties
Het maken van onderscheid tussen ongecompliceerde en gecompliceerde urineweginfecties is een essentiële eerste stap voor het sturen van de behandeling. Ongecompliceerde urineweginfecties zijn een van de meest behandelde soorten infecties in de eerstelijnsgezondheidszorg. Vrouwen lopen het grootste risico, met een incidentie van bijna 50% over hun hele leven en een recidiefpercentage van ongeveer 33%.8
De meerderheid van de patiënten met een ongecompliceerde urineweginfectie zijn premenopauzale vrouwen die niet zwanger zijn en weinig of geen comorbiditeiten hebben. Deze patiënten presenteren zich meestal met symptomen van cystitis, zoals dysurie, frequentie en urgentie.9 Suprapubische pijn en hematurie zijn ongewoon, en pyelonefritis komt niet voor.
Een gecompliceerde urineweginfectie komt meestal voor bij patiënten van beide geslachten met structurele of functionele afwijkingen van de urinewegen.9 Deze patiënten hebben vaak eerdere urologische ingrepen ondergaan, zijn recentelijk blootgesteld aan antibiotica, zijn recentelijk of langdurig gekatheteriseerd, of zijn recentelijk of momenteel in het ziekenhuis opgenomen (ziekenhuisverworven urineweginfecties). Andere risicogroepen zijn zwangere vrouwen, patiënten met diabetes mellitus, en patiënten met andere immunocompromiserende aandoeningen.
Patiënten met gecompliceerde urineweginfecties presenteren zich meestal met symptomen van pyelonefritis, waaronder koorts, koude rillingen en pijn in de flanken, met of zonder misselijkheid. Zij kunnen een bevestigde of vermoede voorgeschiedenis van infectie(s) met virulentere bacteriën hebben. Urinekweken kunnen diverse microbiota en bovengemiddelde patronen van antimicrobiële resistentie aantonen. Helaas kunnen beide factoren de werkzaamheid van antimicrobiële therapie ondermijnen.
Wanneer een urinekweek en gevoeligheid te overwegen
Historisch was de diagnostische gouden standaard voor urineweginfecties het uitvoeren van een standaard urinekweek (dat wil zeggen, 1 microliter midstream urine verdelen over 5% schapenbloed en McConkey agars en deze aëroob incuberen).1 In deze context werd een urineweginfectie gedefinieerd als de aanwezigheid van een geïsoleerd, bekend uropathogeen met een concentratie van >105 CFU/ml of >102 CFU/ml bij een symptomatische patiënt. Gezien de hoge prevalentie van urineweginfecties en het feit dat een urinekweek geen point-of-care test is, is het de moeite waard om te overwegen wanneer het mogelijk is om een kweek achterwege te laten zonder de behandeluitkomsten in gevaar te brengen.
De huidige richtlijnen van de Infectious Diseases Society of America (IDSA) bevelen geen routinematige standaard urinekweek aan voor patiënten met verdenking op ongecompliceerde urineweginfecties.10 Er zijn aanzienlijke aanwijzingen dat urineonderzoek in deze setting informatief is. In één onderzoek had ongeveer 94% van de patiënten met een negatieve urineanalyse ook een negatieve kweek.11 In een longitudinaal retrospectief onderzoek bij bijna 21.000 vrouwelijke poliklinische patiënten was een negatieve urineanalyse geassocieerd met een 2,5-voudig grotere kans op een negatieve kweek (<103 CFU/ml) in vergelijking met een positieve urineanalyse.12 Bij patiënten met terugkerende symptomen van urineweginfectie waren een eerdere negatieve urineanalyse of urinekweek of huidige vaginale irritatie of afscheiding geassocieerd met statistisch significante toenames in de waarschijnlijkheid van een negatieve kweek.
Leukocytenesterase is vooral informatief bij de beoordeling van vermoedelijke ongecompliceerde urineweginfecties. In een grote retrospectieve studie van meer dan 8.500 van dergelijke patiënten voorspelde een negatieve uitslag voor leukocytenesterase een negatieve urinekweekuitslag met 95% nauwkeurigheid (negatief voorspellende waarde, 0,95), terwijl negatieve uitslagen voor zowel leukocytenesterase als nitraat slechts iets nauwkeuriger waren (gecombineerde negatief voorspellende waarde, 0,96).13 Opmerkelijk is dat een negatieve nitraatuitslag alleen duidelijk minder betrouwbaar was voor het voorspellen van een negatieve urinekweekuitslag (negatief voorspellende waarde, 0,87).
Voor patiënten met ongecompliceerde urineweginfecties bevelen de IDSA-richtlijnen een keuze uit de volgende middelen aan voor empirische antimicrobiële therapie:10
– Nitrofurantoïne 100mg tweemaal daags (BID) gedurende 5 dagen
– Trimethoprim/sulfamethoxazol (Bactrim DS) gedurende 3 dagen als het lokale resistentiepercentage <20% is (als u nog geen toegang heeft tot deze gegevens, overweeg dan contact op te nemen met lokale, provinciale of staatsgezondheidsafdelingen)
– Fosfomycine (eenmalige dosis van 3 gram)
– Merk op dat fluorochinolonen zoals ciprofloxacine niet langer worden aanbevolen voor ongecompliceerde urineweginfecties vanwege de hoge resistentiegraad in sommige gebieden
– Bovendien moet de selectie van antimicrobiële therapie voor ongecompliceerde urineweginfecties worden geleid door lokale patronen van antimicrobiële resistentie en de beste, geïnformeerde gok van de clinicus over de meest waarschijnlijke uropathogeen. In een studie van meer dan 9000 vrouwen met door kweken bevestigde ongecompliceerde infecties van de urinewegen was 19% van de isolaten resistent tegen trimethoprim-sulfamethoxazol en 12% tegen nitrofurantoïne (10% was resistent tegen ciprofloxacine, dat niet langer wordt aanbevolen voor empirische therapie).14 Significante voorspellers van antimicrobiële resistentie waren onder meer het wonen in een postcode met bovengemiddelde percentages antimicrobiële resistentie, een voorgeschiedenis van infectie met een resistent uropathogeen, of het voorgeschreven krijgen van antimicrobiële therapie in de afgelopen 2 jaar. Op basis van deze gegevens ontwikkelden de onderzoekers een algoritme dat in 92% van de gevallen de juiste antimicrobiële therapie selecteerde, wat hoger was dan het percentage van 87,5% dat door de zorgverlener werd gekozen.
In conclusie, voor patiënten met ongecompliceerde urineweginfecties is een traditionele urinekweek niet verouderd, maar in de meeste gevallen wel onnodig.
Voor patiënten bij wie een gecompliceerde urineweginfectie wordt vermoed, moeten clinici een eerste (empirische) antimicrobiële therapie selecteren op basis van historische kweek- en gevoeligheidsgegevens, indien beschikbaar, in aanvulling op de huidige resultaten van urineonderzoek en lokale patronen van antimicrobiële resistentie. Als het urineonderzoek negatief is en de patiënt een voorgeschiedenis van negatieve kweken heeft, is er volgens recente gegevens een waarschijnlijkheid van 87% dat de huidige symptomen niet worden veroorzaakt door een urineweginfectie.12 Deze patiënten moeten worden geëvalueerd op andere oorzaken van hun symptomen, zoals chronisch bekkenpijnsyndroom (CPPS) of tumoren van de urinewegen. Als het urineonderzoek positief is, raad ik aan empirisch te behandelen en een urinekweek en sensitiviteit te bestellen om de behandeling zo nodig aan te passen.
De urine is niet steriel
Tot voor kort was het paradigma voor het behandelen van zowel ongecompliceerde als gecompliceerde infecties het elimineren van micro-organismen uit de urinewegen. Deskundigen erkennen nu dat deze aanpak wordt beperkt door twee belangrijke factoren: microbiota zijn aanwezig in de asymptomatische (gezonde) urinewegen, en standaard kweken zijn relatief ongevoelig voor de detectie van micro-organismen in de urinewegen.
Er is steeds meer bewijs voor het bestaan van een divers urinemicrobioom, dat het oude klinische adagium “urine is steriel” weerlegt.15 In een recente studie hebben onderzoekers kwantitatieve PCR van 16S ribosomaal RNA van 16 urinemonsters van gezonde mannen en vrouwen in de leeftijd van 26 tot 90 jaar uitgevoerd.16 Vijf monsters testten positief op één bacteriële fylum en één tot zes genera, terwijl de rest gemiddeld vijf fyla en acht tot 36 genera bevatte. In een andere studie voerden onderzoekers high-throughput PCR-sequencing uit op urinemonsters van acht vrouwen, die allemaal negatieve standaard urinekweken hadden.17 Alle monsters waren polymicrobieel en vertoonden een aanzienlijke variabiliteit tussen de monsters: er werden 45 unieke bacteriesoorten geïdentificeerd, waarvan er negen in verband werden gebracht met infecties van de urinewegen en 20 van onbekend pathogeen potentieel waren. Vergelijkbare studies hebben deze bevinding bevestigd,18 wat suggereert dat urine van gezonde personen vaak bacteriën bevat die door standaard urinekweken niet worden gedetecteerd.
Een andere studie ging dieper door gebruik te maken van verbeterde kwantitatieve urinekweek (EQUC) om te bepalen of bacteriën geïdentificeerd in urinemonsters levensvatbaar waren.19 Deze methode omvat het uitplaten van grotere volumes urine, het incuberen van monsters onder een breder bereik van groeiomstandigheden, en het gebruik van langere incubatieperioden. Uit 65 urinemonsters die met EQUC werden onderzocht, kweekte 80% van de bacteriën, waarvan 92% niet met een standaardkweek werd opgespoord. Er werden 35 geslachten geïdentificeerd, waarvan Lactobacillus, Corynebacterium, Streptococcus, Actinomyces en Staphylococcus de meest voorkomende waren. De meeste bacteriesoorten vermenigvuldigden zich tot aantallen onder de detectiegrens van standaard urinekweekprotocollen. Deze bevindingen werden bevestigd door een andere recente studie onder 150 volwassenen (waarvan de helft urinesymptomen rapporteerde), waarin met behulp van EQUC 182 uropathogenen werden gedetecteerd, drie keer zoveel als met standaardkweken.20
De resultaten van deze studies bevestigen gezamenlijk dat zowel bij gezonde personen als bij patiënten met urinesymptomen diverse urinemicrobiota aanwezig zijn, en dat standaard urinekweekmethoden relatief ongevoelig zijn voor het karakteriseren van dit microbioom, inclusief uropathogenen. Standaardkweken bootsen ook niet op betrouwbare wijze biofilms na, zoals die welke in urinekatheters worden gevormd, en het duurt dagen voordat de eindresultaten van standaardkweken en gevoeligheidstests kunnen worden gerapporteerd.11,21 Het is duidelijk dat er ruimte is voor verbetering.
Nieuwe, in de handel verkrijgbare tests voor urineweginfecties
Drie in de handel verkrijgbare urinetests detecteren uropathogenen met een grotere gevoeligheid dan de standaard urinekweek en screenen ook snel op tekenen van antimicrobiële resistentie (tabel 1).18,19,22 Mogelijke voordelen van deze tests zijn een snellere identificatie van ziekteverwekkers, nauwkeurigere gevoeligheidsuitslagen en een geïndividualiseerde behandeling, wat in theorie allemaal de patiëntuitkomsten kan verbeteren.23,24,25
De Vikor Urine-ID™-test is een PCR-gebaseerde test die in staat is om meerdere soorten bacteriën te detecteren en ook tot 30 bacteriële genen kan identificeren die coderen voor resistentie tegen antimicrobiële middelen.26 De testresultaten zijn beschikbaar in ongeveer 12 tot 24 uur (tabel 1). Samen met de testresultaten geeft de fabrikant informatie over regionale antimicrobiële gevoeligheidspatronen, het activiteitenspectrum van antibiotica, medicatiekosten, en relevante richtlijnen van de U.S. Food and Drug Administration (FDA).
De MicroGenDX UTI Urinalyse Kit bestaat uit twee stappen.27 Eerst wordt kwantitatieve PCR gebruikt om te screenen op 16 soorten bacteriën en Candida albicans, waarvan de resultaten binnen 24 uur worden geleverd. Ten tweede wordt next-generation sequencing (NGS) gebruikt om microbiota-DNA van het urinespecimen te vergelijken met een database van meer dan 30.000 microbiële soorten, met resultaten binnen 3 tot 5 dagen (tabel 1). Volgens de fabrikant identificeert de UTI Urinalysis Kit alle microben in een urinemonster met een nauwkeurigheid van 99,9%.
Tabel 1. Overzicht van nieuwe in de handel verkrijgbare tests voor urineweginfecties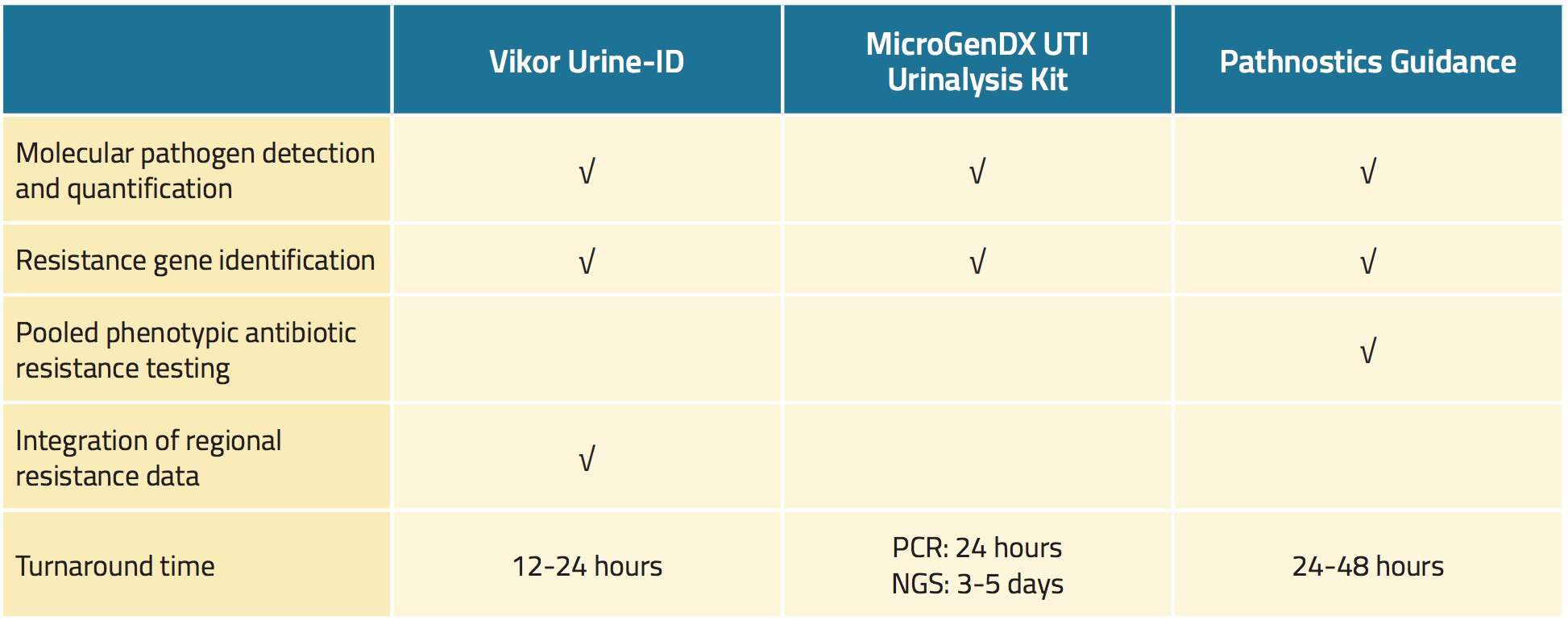
De Pathnostics Guidance-assay bestaat uit een reeks nieuwe urinetests voor patiënten met prostatitis, interstitiële cystitis en terugkerende urineweginfecties.28 De assay voor infectie van de urinewegen maakt gebruik van PCR om 45 pathogenen en 38 resistentiegenen te screenen. De Pathnostics Guidance-test genereert ook fenotypische gegevens en gepoolde antimicrobiële gevoeligheidsresultaten. Voor de test kan zowel urine uit de urinebak als urine via een katheter worden gebruikt, die tot 5 dagen bij kamertemperatuur kan worden bewaard. Resultaten zijn beschikbaar binnen 24 tot 28 uur.
Eén waarschuwing is op zijn plaats. Zoals we hebben besproken, kunnen deze zeer gevoelige testen bacteriën detecteren in de urine van asymptomatische personen en personen bij wie de symptomen niet gerelateerd zijn aan urineweginfecties. Daarom mogen clinici hun behandelingsbeslissingen niet alleen op de testresultaten baseren. Dat kan nadelige gevolgen hebben voor de patiënt. In een onderzoek bij 673 jonge vrouwen en vrouwen van middelbare leeftijd met asymptomatische bacteriurie en een voorgeschiedenis van terugkerende urineweginfecties, kreeg de helft van de patiënten antimicrobiële therapie en de rest niet.22 Na 6 maanden en 12 maanden follow-up werd antimicrobiële therapie geassocieerd met statistisch significante stijgingen van het aantal terugkerende urinewegsymptomen. Om overmatig gebruik van antimicrobiële middelen en de daarmee gepaard gaande bijwerkingen, kosten en selectie op antimicrobiële resistentie te voorkomen, is het van vitaal belang dat artsen de testresultaten evalueren in de context van het algehele risico en de voorgeschiedenis van urineweginfecties en de huidige klinische presentatie van de patiënt.
Toekomstige richtingen voor testen op basis van urine
Ondanks het feit dat recent goedgekeurde testen de opsporing en behandeling van urineweginfecties aanzienlijk kunnen verbeteren in vergelijking met alleen een standaard kweek, blijven onderzoekers zoeken naar manieren om de diagnose, detectie van ziekteverwekkers, de kwantificering van antimicrobiële gevoeligheid en behandelingsalgoritmen te verbeteren. Voorbeelden hiervan zijn het gebruik van technieken voor machinaal leren, samengestelde analyses van nieuwe biomarkers, en tests voor cellulaire eiwitsignaturen.
Machine-learning algoritmen hebben een vroege belofte laten zien voor het verbeteren van de detectie en evaluatie van patiënten met ongecompliceerde urineweginfecties. Een studie evalueerde bijvoorbeeld 17 klinische variabelen en 42 immunologische variabelen om de beste voorspellers van de resultaten van een urinekweek te identificeren. Troebelheid van de urine (troebelheid) was de beste klinische voorspeller, met een positief voorspellende waarde van 0,65 (wat betekent dat de aanwezigheid van troebelheid van de urine een kweek-positief specimen identificeerde met 65% nauwkeurigheid) en een negatief voorspellende waarde van 0,65 (wat betekent dat de aanwezigheid van troebelheid van de urine een kweek-positief specimen identificeerde met 65% nauwkeurigheid).79 (wat betekent dat de afwezigheid van urinetroebiditeit een kweeknegatief specimen identificeerde met 79% nauwkeurigheid).29 Vandaar dat urinetroebiditeit relatief ongevoelig was maar een redelijke specificiteit vertoonde voor de detectie van een kweekpositief specimen. Vier biomarkers in de urine – matrix metallopeptidase 9, neutrofiel gelatinase-geassocieerd lipocaline, interleukine (IL)-8, en IL-1β – hadden samen een aanzienlijk hogere positief voorspellende waarde van 0,82, en een vergelijkbare negatief voorspellende waarde van 0,76. Hoewel het combineren van deze vier urine biomarkers met urine troebelheid deze voorspellende waarden niet verder verbeterde, gaven de resultaten van de studie aan dat machine learning algoritmen de meeste patiënten met ongecompliceerde urineweginfecties betrouwbaar kunnen identificeren.29
Als machine learning modellen verfijnder worden, zouden hun voorspellende waarden kunnen verbeteren, wat de diagnose en behandeling van urineweginfecties in kwetsbare populaties verder zou kunnen verbeteren en tegelijkertijd de diagnostische werklast zou kunnen verminderen. Een recente grote studie analyseerde bijvoorbeeld meer dan 212.000 rapporten van urinemicroscopie-, kweek- en gevoeligheidsresultaten van drie ziekenhuizen en poliklinische diensten in Groot-Brittannië.30 Specifieke algoritmen voor machinaal leren werden ontworpen voor subgroepen met een hoog risico, zoals zwangere vrouwen, kinderen en personen met persisterende of terugkerende urineweginfecties. Machine learning detecteerde ongeveer 95% van de kweekpositieve specimens, terwijl de werklast in verband met urinekweek met ongeveer 41% werd verminderd en een ongeveer 24% hogere specificiteit werd bereikt dan met een heuristisch model op basis van witte bloedcellen en bacterietellingen. Deze resultaten zijn vooral opmerkelijk in een tijdperk waarin de vergrijzing van de bevolking en de opkomst van antimicrobieel resistente bacteriën de noodzaak vergroten om urineweginfecties die behandeling vereisen efficiënt en nauwkeurig op te sporen.
Recidiverende urineweginfecties (historisch gedefinieerd als ten minste twee urineweginfecties in de afgelopen 6 maanden, of meer dan drie infecties in het afgelopen jaar) blijken ongeveer 50% te treffen bij vrouwen ouder dan 55 jaar en 27% van jongere vrouwen.31, 32 De huidige richtlijnen roepen op tot intensieve behandeling met maatregelen zoals profylactische antimicrobiële therapie, beperking van het gebruik van zaaddodende middelen, urineren na de geslachtsgemeenschap, immunoactieve profylaxe met OM-89, vaginale vaccinatie met Urovac, en het gebruik van vaginale oestrogeencrèmes of -ringen bij postpartumvrouwen.31, 33 Analyses van serum- en urinebiomarkers zouden kunnen helpen beter te voorspellen welke patiënten terugkerende urineweginfecties zullen ontwikkelen, zodat zij eerder gerichte interventies krijgen.32 Relevante biomarkers voor terugkerende urineweginfecties zijn onder andere verlaagde serumspiegels van vitamine D en prostaat-specifiek antigeen, verhoogde serumspiegels van immunoglobulinen, granulocyte kolonie-stimulerende factor, macrofaag kolonie-stimulerende factor, en IL-5, terwijl relevante biomarkers voor urine onder andere verhoogde spiegels van IL-8 en verlaagde spiegels van zenuwgroeifactor en neutrofiele gelatinase-geassocieerd lipocaline zijn.
Toekomstige diagnostiek kan ook bestaan uit point-of-care biomarker assays die de noodzaak van urinekweken aanvullen of verminderen. Een ideale test zou even snel en goedkoop zijn als een urinedipsticktest, maar preciezer en nauwkeuriger. Mogelijke kandidaten zijn trimethylamine en acetaat, markers van bacterieel metabolisme, en xanthine oxidase en myeloperoxidase, enzymatische biomarkers.34
Toekomstige assays zouden ook het urinair exosoom kunnen evalueren als een potentiële biomarker voor urineweginfecties. Het exosoom bestaat uit kleine extracellulaire blaasjes die cellulaire eiwitten bevatten. In één studie waren de eiwitten Akt (een intracellulair signaleringseiwit) en CD9 (een intracellulair transmembraaneiwit) significant verhoogd bij vrouwen met urineweginfecties in vergelijking met vrouwen met asymptomatische bacteriurie, en de niveaus van beide eiwitten daalden significant na antimicrobiële therapie.35 De resultaten van dergelijke studies zouden ooit de ontwikkeling kunnen bevorderen van commerciële testen die het urinair exosoom evalueren om te helpen bij het nemen van beslissingen over behandeling.
Samenvattend
De evaluatie en behandeling van urineweginfecties is een integraal onderdeel van de urologische praktijk. Voor ongecompliceerde urineweginfecties is een urinekweek meestal niet nodig, en is empirische behandeling volgens de huidige IDSA-richtlijnen aangewezen. Empirische therapie op basis van historische kweek- en gevoeligheidsresultaten is ook geschikt voor gecompliceerde urineweginfecties, maar moet worden aangepast op basis van de huidige kweek en gevoeligheid. Recidiverende urineweginfecties kunnen intensieve therapeutische en gedragsinterventies rechtvaardigen. oewel dit onze huidige beste praktijken zijn, is er nog veel ruimte voor verbetering, vooral gezien recent bewijs voor het bestaan van een urinewegmicrobioom en de beperkingen van standaard screening en kweek. Er is behoefte aan snelle, betrouwbare tests om uropathogenen beter op te sporen, klinisch zinvolle urinaire dysbiose te onderscheiden van klinisch onbelangrijke bacteriurie, en antimicrobiële therapie te sturen op basis van gepersonaliseerde resistentiegegevens. Gevoeligheidsanalyses op basis van kwantitatieve PCR en next-generation sequencing zijn nu beschikbaar. In de toekomst kan ook het gebruik van verbeterde kwantitatieve urinekweekmethoden de klinische zorg verbeteren. Onderzoekers evalueren ook algoritmen voor machinaal leren die serum- en urinebiomarkers en andere klinische variabelen integreren om urineweginfecties doeltreffender op te sporen, recidieven te voorspellen en de diagnostische werklast te verminderen. De integratie van deze nieuwe benaderingen met gegevens over lokale resistentie en ziekenhuisheropnames kan de bruikbaarheid ervan vergroten. Het einddoel is om gevoelige, specifieke, kosteneffectieve tests en praktische algoritmen te ontwikkelen die het management en de patiëntresultaten verbeteren.
Schrijven door: Edward Schaeffer, MD, Ph.D., voorzitter, afdeling Urologie, Feinberg School of Medicine, programmadirecteur, Genitourinary Oncology Program, Robert H. Lurie Comprehensive Cancer Center, Northwestern University, Chicago, Illinois
1. Schaeffer, AJ., Matulewicz, RS., & Klumpp, DJ. (2016). Infecties van de urinewegen. In AJ. Wein, & et al (Eds.), Campbell-Walsh Urology, Eleventh Edition Philadelphia: Elsevier-Saunders.
2. Schappert, S. M., and E. A. Rechtsteiner. “Schattingen van het gebruik van ambulante medische zorg voor 2007. Vital and Health Statistics. Series 13, Data from the National Health Survey 169 (2011): 1-38.
3. Foxman, Betsy. “Urinary tract infection syndromes: occurrence, recurrence, bacteriology, risk factors, and disease burden.” Infectious disease clinics of North America 28, no. 1 (2013): 1-13.
4. Foxman, Betsy. “The epidemiology of urinary tract infection.” Nature Reviews Urology 7, no. 12 (2010): 653.
5. Simmering, Jacob E., Fan Tang, Joseph E. Cavanaugh, Linnea A. Polgreen, en Philip M. Polgreen. “The increase in hospitalizations for urinary tract infections and the associated costs in the United States, 1998-2011.” In Open forum infectieziekten, vol. 4, no. 1. Oxford University Press, 2017.
6. Nguyen, Hoa Q., Nga TQ Nguyen, Carmel M. Hughes, and Ciaran O’Neill. “Trends en impact van antimicrobiële resistentie op oudere intramurale patiënten met urineweginfecties (UTI’s): A national retrospective observational study.” PloS one 14, no. 10 (2019).
7. Critchley, Ian A., Nicole Cotroneo, Michael J. Pucci, and Rodrigo Mendes. “The burden of antimicrobial resistance among urinary tract isolates of Escherichia coli in the United States in 2017.” PloS one 14, no. 12 (2019).
8.Gupta, Kalpana, and Barbara W. Trautner. “Diagnose en behandeling van recidiverende urineweginfecties bij niet-zwangere vrouwen.” Bmj 346 (2013): f3140.
9. Tan, Chee Wei, en Maciej Piotr Chlebicki. “Urineweginfecties bij volwassenen.” Singapore medical journal 57, no. 9 (2016): 485.
10. Gupta, Kalpana, Thomas M. Hooton, Kurt G. Naber, Björn Wullt, Richard Colgan, Loren G. Miller, Gregory J. Moran et al. “International clinical practice guidelines for the treatment of acute uncomplicated cystitis and pyelonephritis in women: a 2010 update by the Infectious Diseases Society of America and the European Society for Microbiology and Infectious Diseases.” Klinische infectieziekten 52, no. 5 (2011): e103-e120.
11. Huang, Bin, Lei Zhang, Weizheng Zhang, Kang Liao, Shihong Zhang, Zhiquan Zhang, Xingyan Ma et al. “Direct detection and identification of bacterial pathogens from urine with optimized specimen processing and enhanced testing algorithm.” Journal of clinical microbiology 55, no. 5 (2017): 1488-1495.
12. Cohen, Jason E., Emily M. Yura, Liqi Chen, en Anthony J. Schaeffer. “Predictive Utility of Prior Negative Urine Cultures in Women with Suspected Recurrent Uncomplicated Urinary Tract Infections.” The Journal of urology 202, no. 5 (2019): 979-985.
13. Marques, Alexandre Gimenes, Jacyr Pasternak, Márcio dos Santos Damascena, Carolina Nunes França, and Marinês Dalla Valle Martino. “Prestatie van de dipstick screening test als voorspeller van een negatieve urinekweek.” Einstein (São Paulo) 15, no. 1 (2017): 34-39.
14. Cohen, Jason E., Liqi Chen, en Anthony J. Schaeffer. “Algoritmen die gebruik maken van eerdere resistentie, eerdere antimicrobiële voorschriften en de woonplaats van de patiënt verbeteren de empirische therapie voor vrouwen met ongecompliceerde urineweginfecties.” Urology 137 (2020): 72-78.
15. Finucane, Thomas E. “‘Urinary tract infection’ (Urineweginfectie) en het microbioom.” The American journal of medicine 130, no. 3 (2017): e97-e98.
16. Lewis, Debbie Ann, Richard Brown, Jon Williams, Paul White, Susan Kim Jacobson, Julian Marchesi, en Marcus John Drake. “The human urinary microbiome; bacterial DNA in voided urine of asymptomatic adults.” Frontiers in cellular and infection microbiology 3 (2013): 41.
17. Siddiqui, Huma, Alexander J. Nederbragt, Karin Lagesen, Stig L. Jeansson, and Kjetill S. Jakobsen. “Het beoordelen van de diversiteit van de vrouwelijke urine microbiota door middel van high throughput sequencing van 16S rDNA amplicons.” BMC microbiology 11, no. 1 (2011): 244.
18. Wolfe, Alan J., Evelyn Toh, Noriko Shibata, Ruichen Rong, Kimberly Kenton, MaryPat FitzGerald, Elizabeth R. Mueller et al. “Evidence of uncultivated bacteria in the adult female blader.” Journal of clinical microbiology 50, no. 4 (2012): 1376-1383.
19. Hilt, Evann E., Kathleen McKinley, Meghan M. Pearce, Amy B. Rosenfeld, Michael J. Zilliox, Elizabeth R. Mueller, Linda Brubaker, Xiaowu Gai, Alan J. Wolfe, and Paul C. Schreckenberger. “Urine is niet steriel: het gebruik van verbeterde urinekweektechnieken om de residente bacteriële flora in de blaas van de volwassen vrouw op te sporen.” Journal of clinical microbiology 52, no. 3 (2014): 871-876.
20. Price, Travis K., Tanaka Dune, Evann E. Hilt, Krystal J. Thomas-White, Stephanie Kliethermes, Cynthia Brincat, Linda Brubaker, Alan J. Wolfe, Elizabeth R. Mueller, and Paul C. Schreckenberger. “De klinische urinekweek: verbeterde technieken verbeteren de detectie van klinisch relevante micro-organismen.” Journal of clinical microbiology 54, no. 5 (2016): 1216-1222.
21. Sathiananthamoorthy, Sanchutha, James Malone-Lee, Kiren Gill, Anna Tymon, Trang K. Nguyen, Shradha Gurung, Linda Collins et al. “Reassessment of routine midstream culture in diagnosis of urinary tract infection.” Journal of clinical microbiology 57, no. 3 (2019): e01452-18.
22. Cai, Tommaso, Sandra Mazzoli, Nicola Mondaini, Francesca Meacci, Gabriella Nesi, Carolina D’Elia, Gianni Malossini, Vieri Boddi, en Riccardo Bartoletti. “The role of asymptomatic bacteriuria in young women with recurrent urinary tract infections: to treat or not to treat?” Klinische infectieziekten 55, no. 6 (2012): 771-777.
23. Lehmann, Lutz E., Stefan Hauser, Thomas Malinka, Sven Klaschik, Stefan U. Weber, Jens-Christian Schewe, Frank Stüber, and Malte Book. “Snelle kwalitatieve identificatie van pathogenen voor urineweginfecties door SeptiFast® real-time PCR. PLoS One 6, no. 2 (2011).
24. Schmidt, K., K. K. Stanley, R. Hale, L. Smith, J. Wain, J. O’grady, and D. M. Livermore. “Evaluation of multiplex tandem PCR (MT-PCR) assays for the detection of bacterial resistance genes among Enterobacteriaceae in clinical urines.” Journal of Antimicrobial Chemotherapy 74, no. 2 (2019): 349-356.
25. Barczak, Amy K., James E. Gomez, Benjamin B. Kaufmann, Ella R. Hinson, Lisa Cosimi, Mark L. Borowsky, Andrew B. Onderdonk et al. “RNA-handtekeningen maken snelle identificatie van ziekteverwekkers en antibioticagevoeligheden mogelijk.” Proceedings of the national academy of sciences 109, no. 16 (2012): 6217-6222.
26. Urine-IDTM – Vikor Scientific. https://www.vikorscientific.com/test-menu/urine-id/. Geraadpleegd op 15 februari 2020.
27. UTI Urine Kit – Verzekering | MicroGen Diagnostics. https://microgendx.com/product/urine-kit-ins/. Geraadpleegd op 15 februari 2020.
28. Begeleiding – Pathnostics. https://www.pathnostics.com/physicians/tests/guidance/. Geraadpleegd op 15 februari 2020.
29. Gadalla, Amal AH, Ida M. Friberg, Ann Kift-Morgan, Jingjing Zhang, Matthias Eberl, Nicholas Topley, Ian Weeks et al. “Identification of clinical and urine biomarkers for uncomplicated urinary tract infection using machine learning algorithms.” Scientific Reports 9, no. 1 (2019): 1-11.
30. Burton, Ross J., Mahableshwar Albur, Matthias Eberl, and Simone M. Cuff. “Het gebruik van kunstmatige intelligentie om de diagnostische werklast te verminderen zonder de opsporing van urineweginfecties in gevaar te brengen.” BMC medical informatics and decision making 19, no. 1 (2019): 171.
31. Bonkat, G., R. Pickard, R. Bartoletti, F. Bruyere, S. E. Geerlings, en F. Wagenlehner. “Richtlijnen voor urologische infecties. EAU Guidelines.” European Association of Urology (2017).
32. Jhang, Jia-Fong, en Hann-Chorng Kuo. “Recente vooruitgang in recidiverende urineweginfectie van pathogenese en biomarkers tot preventie.” Tzu-Chi Medical Journal 29, no. 3 (2017): 131.
33. Dason, Shawn, Jeyapandy T. Dason, en Anil Kapoor. “Richtlijnen voor de diagnose en behandeling van recidiverende urineweginfecties bij vrouwen.” Canadian Urological Association Journal 5, no. 5 (2011): 316.
34. Karlsen, H., en T. Dong. “Biomarkers of urinary tract infections: state of the art, and promising applications for rapid strip-based chemical sensors.” Analytical Methods 7, no. 19 (2015): 7961-7975.
35. Mizutani, Kosuke, Kyojiro Kawakami, Kengo Horie, Yasunori Fujita, Koji Kameyama, Taku Kato, Keita Nakane et al. “Urinary exosome as a potential biomarker for urinary tract infection.” Cellular microbiology 21, no. 7 (2019): e13020.
Gerelateerde inhoud:
Download: Everyday Urology: Volume 5, Issue 1