Wetenschapsprojecten voor Beginners: Scheikunde
Scheikunde
Zout of Suiker: Wat lost sneller op in verschillende vloeistoffen
Oplossingen zijn niets meer dan mengsels van verschillende verbindingen of elementen. Je komt elke dag oplossingen tegen zonder dat je het beseft.
Zelfs de lucht die je inademt, en die water bevat, is een oplossing van een vloeistof en een gas. Als je vandaag frisdrank hebt gedronken, heb je eigenlijk een oplossing van een gas gedronken, opgelost in water met een smaakje. Als je een armband draagt van sterling zilver, dan draag je een oplossing van twee metalen.
In dit experiment werk je met een vloeibare oplossing, dat is een van de drie soorten oplossingen. De andere zijn gasvormige oplossingen en vaste oplossingen.
Dus wat lijkt het probleem te zijn?
Een oplosmiddel is de stof, ofwel een vaste stof, vloeistof of gas, die wordt opgelost. Een oplosmiddel, dat ook een vaste stof, een vloeistof of een gas kan zijn, is de stof die het oplossen doet. Een oplossing is een homogeen mengsel van een opgeloste stof (meestal een vaste stof) opgelost in een oplosmiddel (meestal een vloeistof).
Wanneer je een lepel suiker in een glas water roert, vorm je een oplossing. Dit type vloeibare oplossing bestaat uit een vaste stof, de suiker, en een vloeibaar oplosmiddel, het water. Als de suikermoleculen zich gelijkmatig over het water verspreiden, lost de suiker op.
Meng je een vloeistof met een gas, dan ontstaat een ander type oplossing, een gasvormige oplossing genoemd. Een voorbeeld van dit type oplossing is vochtigheid. Vochtigheid is water (een vloeistof) opgelost in lucht (een gas).
Bedenk eens hoe een suikerklontje oplost in water, vergeleken met een pakje losse suiker. Het suikerklontje lost langzamer op omdat er in eerste instantie minder suikermoleculen in contact komen met het water.
In een vaste oplossing, zoals sterlingzilver, wordt koper dat bij hoge temperatuur is verhit, gemengd met zilver dat ook is verhit tot het smelt. Het koper is het oplosmiddel, dat wil zeggen de stof die oplost in het oplosmiddel. Het zilver is het oplosmiddel.
De aard van de oplossing wordt bepaald door de materiestaat van het oplosmiddel. Als de stof die oplost een vloeistof is, wordt de oplossing een vloeibare oplossing genoemd. Als het oplosmiddel een gas is, wordt de oplossing een gasvormige oplossing genoemd. En je hebt het goed geraden: Een vast oplosmiddel vormt een vaste oplossing.
Je kunt de grootte van zout- en suikerkristallen bekijken onder een microscoop of vergrootglas, waarmee je ook hun vorm kunt zien. Als je tekent wat je ziet, met een potlood zodat je de arcering kunt illustreren, kun je de illustratie opnemen als onderdeel van je eindpresentatie van je wetenschapsbeurs-project.
Er zijn een paar factoren die over het algemeen de hoeveelheid oplosmiddel die kan worden opgelost vergroten. Als je bijvoorbeeld meer suiker wilt oplossen in dezelfde hoeveelheid water, kun je het water verhitten. Je kunt de suiker ook tot kleinere deeltjes vermalen om het oppervlak te vergroten, of je kunt het mengsel roeren.
In de jaren dat je zout en suiker op je eten gebruikt, is het je waarschijnlijk opgevallen dat elk stukje zout?dat eigenlijk een kristal is, iets kleiner is dan elk stukje suiker, dat ook een kristal is.
Een molecuul zijn twee of meer elementen die chemisch gecombineerd zijn. Een zoutmolecuul bevat natrium en chloor, die chemisch worden gecombineerd tot natriumchloride. De chemische formule voor dit zout is NaCl. Een suikermolecuul bevat koolstof, waterstof en zuurstof. De chemische formule voor suiker is C12H22O11.
Het probleem dat je in dit experiment probeert op te lossen is of suiker of zout sneller oplost wanneer het in verschillende vloeistoffen wordt gemengd. Heeft de grootte van de stukjes invloed op hoe snel ze met de vloeistof mengen?
Wanneer je suiker of zout in een vloeistof, bijvoorbeeld water, oplost, is het resultaat dat de suikermoleculen zich tussen de watermoleculen in een glas of bekerglas gaan nestelen. De illustratie hieronder laat zien hoe de verschillende moleculen in het bekerglas zijn gerangschikt.
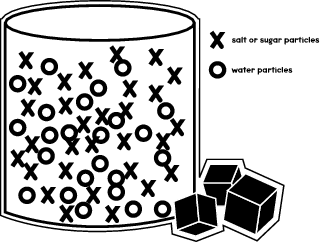
In je experiment zul je zien hoe zout- en suikermoleculen bewegen in verschillende vloeistoffen en met verschillende snelheden oplossen.
De titel van dit gedeelte, ?Zout of suiker: Wat lost sneller op in verschillende vloeistoffen? kan eventueel als titel voor je project dienen. Je kunt ook een van de volgende titels voor je project overwegen:
- De grote zout vs. suiker oploswedstrijd
- Zout en suiker gebruiken om te onderzoeken hoe stoffen oplossen
Welke naam je ook kiest, het is goed. Laten we nu even nadenken waarom dit project een waardevol gebruik van je tijd is.
Wat is het nut?
Wanneer er veel ruimte is tussen de moleculen van een oplosmiddel, wordt gezegd dat het oplosmiddel onverzadigd is. Als er veel oplosmiddel in het oplosmiddel is opgelost, maar er nog wat ruimte tussen de moleculen is, is de oplossing geconcentreerd. Wanneer er helemaal geen opgeloste stof meer in een oplosmiddel kan worden opgelost, is de oplossing verzadigd.
En wanneer het teveel aan opgeloste stof is opgelost door de oplossing te verhitten, spreekt men van een oververzadigde oplossing.
De bedoeling van dit experiment, naast het leren of zout of suiker sneller oplost in verschillende vloeistoffen, is te leren hoe moleculen in een oplossing op elkaar inwerken.
Zoals je in de vorige illustratie hebt gezien, nemen de watermoleculen de meeste ruimte in de container in. Maar er is nog wat ruimte over voor de suiker- of zoutmoleculen. Door je experiment leer je hoe snel de suikermoleculen in die ruimte passen, in vergelijking met de zoutdeeltjes.
Als je dit weet, begrijp je beter het proces dat plaatsvindt als een stof oplost.
De controle in je experiment zal water zijn. De andere vloeistoffen waarin je zout en suiker oplost, zijn de variabelen.
| Controles: | Oplosmiddel?water |
| Oplossingen?suiker, zout | |
| Variabelen: | Vijf verschillende heldere vloeistoffen (kunnen gekleurd zijn) |
Bedenk bij het uitvoeren van je experiment dat het heel belangrijk is dat de vloeistoffen die je gebruikt allemaal dezelfde temperatuur hebben. Je hebt al geleerd dat suiker sneller oplost in een warme vloeistof dan in een koele, dus je weet dat het geen nauwkeurig experiment zou zijn als sommige van de vloeistoffen die je gebruikt warm zijn en andere koud. De temperatuur van de vloeistof zou dan een variabele worden.
Daarom moeten alle vloeistoffen die je gebruikt, inclusief water, op kamertemperatuur zijn. Als je ze normaal in de koelkast bewaart, laat ze dan een nachtje op het aanrecht staan tot ze allemaal dezelfde temperatuur hebben.
Om je wat meer flexibiliteit te geven bij het uitvoeren van het experiment, mag je zelf kiezen in welke vloeistoffen je de suiker en het zout oplost. Het heeft geen zin om extra vloeistoffen te kopen als je al hebt wat je nodig hebt.
Ga er niet van uit dat vloeistoffen die op verschillende plaatsen in je huis hebben gestaan dezelfde temperatuur hebben. Een fles frisdrank die in de garage heeft gestaan, kan bijvoorbeeld een paar graden koeler zijn dan alcohol uit de badkamerkast, of appelsap uit de voorraadkast in de keuken. Zorg ervoor dat alle vloeistoffen zich op dezelfde plaats bevinden, zodat ze dezelfde kamertemperatuur bereiken. If you don’t, the results of your experiment won’t be valid.
Just make sure you choose liquids that are different from each other in taste, color, odor, and purpose. You’ll also need to select those that allow you to observe the salt and sugar as it dissolves. If you use milk or orange juice, for example, you won’t be able to watch the salt and sugar dissolve. Some suggestions for liquids to consider are:
- White vinegar
- Club soda
- Ginger ale
- Glass cleaner (such as Windex)
- Lemonade
- Tea or iced tea (each at room temperature)
- Apple juice
- Rubbing alcohol
All of these are commonly found around the house, perhaps saving you a trip to the store.
What Do You Think Will Happen?
Nu je weet hoe oplossingen tot stand komen en welke factoren van invloed zijn op de snelheid waarmee de suiker en het zout oplossen, kun je wel raden welke oplossing het snelst zal oplossen.
Als je dit experiment nog niet eerder hebt gedaan, weet je niet of de vloeistoffen die je gebruikt een factor zullen zijn bij het oplossen van zout en suiker. Dit maakt het moeilijker om een hypothese te vormen, maar maak je geen zorgen. Of je hypothese juist is of niet, heeft geen invloed op de geldigheid of de uitkomst van je experiment.
Hoewel je pas na je experiment zult weten of de eigenschappen van de verschillende vloeistoffen die je kiest van invloed zullen zijn op de snelheid waarmee zout en suiker oplossen, weet je wel dat zoutkristallen over het algemeen kleiner zijn dan suikerkristallen. En je weet dat de temperatuur van de vloeistoffen geen factor zal zijn in je experiment.
Probeer je ervaringen uit het verleden, de informatie die je eerder in dit hoofdstuk hebt gelezen, en je gezond verstand te gebruiken om tot een goede hypothese te komen.
Houd in gedachten dat je hypothese moet worden geformuleerd als een objectieve zin, niet als een vraag. Dus ga je gang en -maak je gok over de vraag of het zout of de suiker sneller oplost, en laten we beginnen met het experiment.
Materialen die je nodig hebt voor dit project
Een aantal vloeistoffen die je voor dit experiment zou kunnen gebruiken zijn witte azijn, spuitwater, ginger ale, glasreiniger, alcohol, appelsap, limonade, en thee. Als je een of meer van de voorgestelde vloeistoffen wilt vervangen door een andere vloeistof, is dat prima. Zorg er wel voor dat alle vloeistoffen helder zijn en op kamertemperatuur.
De hieronder vermelde hoeveelheden materiaal zijn voldoende om het experiment drie keer uit te voeren met elke vloeistof. You’ll need:
- 12 clear, plastic cups (10 ounce )
- One permanent marker
- One (1 teaspoon) (5.0 ml) measuring spoon
- One (12 teaspoon) (2.5 ml) measuring spoon
- One (1 cup) (240 ml) measuring cup
- 8 teaspoons (40 ml) salt, divided in 16 (12 teaspoon) portions
- 8 teaspoons (40 ml) sugar, divided in 16 (12 teaspoon) portions
- 48 ounces (1,440 ml) water at room temperature
- 24 ounces (720 ml) each of five different, clear liquids, all at room temperature
- One clock or watch with a second hand
- One clear plastic cup containing eight fluid ounces (240 ml) water at room temperature
Remember to make sure that all liquids are at room temperature.
Conducting Your Experiment
When you’ve gathered all your materials, you’ll be ready to begin your experiment. Volg gewoon deze stappen:
Houd een kopje gewoon water in het zicht, zodat je het kunt vergelijken met de bekertjes met zout en suiker. Het is interessant om te zien hoe het uiterlijk van de vloeistoffen verandert als het zout en de suiker oplossen.
Het zal even duren voordat de suiker en het zout zijn opgelost. Voor het beste resultaat, roer de oplossingen niet, omdat dit een extra variabele oplevert. Als je toch moet roeren, roer dan elke oplossing drie keer, en stop dan. Roer pas als u merkt dat er oplossing op de bodem van elk van de twee bakken ligt.
- Schrijf met de permanent marker op zes van de plastic bekertjes ?zout? en op de andere zes ?suiker?
- Doe een halve theelepel (2,5 ml) zout in elk van de zes bekertjes met het opschrift “zout”.
- Doe 1/2 theelepel (2,5 ml) suiker in elk van de zes bekertjes met het opschrift ‘suiker’.
- Voeg 240 ml water toe aan één kopje met zout en één kopje met suiker. Noteer onmiddellijk het tijdstip waarop het water werd toegevoegd op een gegevenskaart zoals die in het volgende deel, “Het experiment bijhouden”.
- Observeer hoe de opgeloste stoffen (zout en suiker) oplossen in het oplosmiddel (water). Noteer op de datakaart het tijdstip waarop je denkt dat elk oplosmiddel volledig is opgelost. Deze tijden zullen waarschijnlijk niet gelijk zijn.
- Bereken de verstreken tijd waarin het oplossen heeft plaatsgevonden. Neem het tijdstip waarop het water aan de bekers werd toegevoegd en het oplossen begon, en trek dit af van het tijdstip waarop het oplossen eindigde. Dit geeft het totaal aantal minuten dat het zout en de suiker nodig hadden om volledig op te lossen in de vloeistof.
- Herhaal stap 4 tot en met 6, met elke andere vloeistof in plaats van het water.
- Was de 12 kopjes, spoel ze af en droog ze goed af.
- Herhaal stap 2 tot en met 8 nog twee keer, voor in totaal drie proeven voor elk van de zes vloeistoffen.
- Bereken de gemiddelde oplostijd van het zout en de suiker in elk van de zes vloeistoffen.
Om de gemiddelde tijd te vinden die nodig was om het zout en de suiker in elke vloeistof op te lossen, telt u de drie genoteerde tijden voor elke vloeistof bij elkaar op en deelt u die door drie. Het getal dat je krijgt als je de tijden deelt, is de gemiddelde tijd.
Het bijhouden van je experiment
Grafieken zoals de volgende kunnen worden gebruikt om informatie voor elk oplosmiddel te registreren. Verander gewoon de namen van de oplosmiddelen in de kop.
Zorg ervoor dat je de tijden noteert terwijl je bezig bent. Vertrouw niet op je geheugen om ze later op te schrijven. Je zult een heleboel getallen hebben tegen de tijd dat je klaar bent met je experiment.
Het allemaal samenvoegen
Wat heb je opgemerkt over de snelheid waarmee het zout en de suiker oplosten? Heb je aangetoond dat je hypothese juist was? Of onjuist? Kon je een soort patroon ontdekken bij het toevoegen van zout en suiker aan de verschillende vloeistoffen? Was het duidelijk dat het zout in sommige vloeistoffen beter en sneller oploste dan de suiker? Kun je een reden bedenken waarom dat zo zou kunnen zijn?
Denk je dat de chemische eigenschappen van de opgeloste stof en het oplosmiddel van invloed waren op de snelheid waarmee de stoffen oplosten?
Hoe meer je over je project weet, hoe beter je in staat zult zijn je gegevens correct te analyseren en tot een goede conclusie te komen.
Verder onderzoek
Zoals eerder vermeld, zijn de factoren die de oplosbaarheid van vaste oplosmiddelen beïnvloeden:
- Verhogen of verlagen van de temperatuur van het oplosmiddel
- Vergroten van het oppervlak van het oplosmiddel
- Overstuiving
Als je met dit project nog een stapje verder zou willen gaan, zou je een experiment kunnen ontwerpen waarin je een?
Je zou de snelheid waarmee suikerklontjes oplossen in vloeistof kunnen vergelijken met de oplossnelheid van kristalsuiker.
Of je zou dezelfde oplossing kunnen gebruiken, bijvoorbeeld suiker, en kunnen testen of roeren de oplossing sneller doet oplossen. Het opwarmen en afkoelen van het oplosmiddel terwijl je dezelfde oplossing toevoegt, is ook een mogelijkheid voor verdere experimenten.
Als je nieuwsgierig bent en bereid bent te experimenteren, kun je waarschijnlijk veel variaties voor dit project bedenken. En omdat voor dit experiment alleen gewone, goedkope materialen nodig zijn, kun je naar hartelust experimenteren.
Uittreksel uit The Complete Idiot’s Guide to Science Fair Projects 2003 door Nancy K. O’Leary en Susan Shelly. Alle rechten voorbehouden, inclusief het recht van gehele of gedeeltelijke reproductie in welke vorm dan ook. Gebruikt volgens afspraak met Alpha Books, een onderdeel van Penguin Group (USA) Inc.
Om dit boek rechtstreeks bij de uitgever te bestellen, bezoek de Penguin USA website of bel 1-800-253-6476. U kunt dit boek ook kopen bij Amazon.com en Barnes & Noble.