Zuurstoffamilie
De zuurstoffamilie bestaat uit de elementen die groep 16 vormen op het periodiek systeem: zuurstof, zwavel, selenium, tellurium en polonium. Deze elementen hebben alle zes elektronen in hun buitenste energieniveau, waardoor zij een aantal gemeenschappelijke chemische eigenschappen hebben. In een ander opzicht verschillen de elementen nogal van elkaar. Zuurstof is een gasvormig niet-metaal; zwavel en selenium zijn vaste niet-metalen; tellurium is een vaste metalloïde; en polonium is een vast metaal.
Woorden om te weten
Zuur: Stoffen die, wanneer zij in water zijn opgelost, met een base kunnen reageren tot zouten waarbij waterstofionen vrijkomen.
Allotroop: Een van twee of meer vormen van een element.
Verbranding: Een vorm van oxidatie die zo snel plaatsvindt dat merkbare warmte en licht worden geproduceerd.
Kraken: Het proces waarbij grote koolwaterstofmoleculen worden afgebroken tot kleinere componenten.
elektrolyse: Het proces waarbij een elektrische stroom een chemische verandering veroorzaakt, meestal de afbraak van een of andere stof.
Isotopen: Twee of meer vormen van hetzelfde element met hetzelfde aantal protonen maar verschillend aantal neutronen in de atoomkern.
Lithosfeer: Het vaste deel van de aarde, in het bijzonder het buitenste deel van de korst.
LOX: Een afkorting voor vloeibare zuurstof.
Metallurgie: De wetenschap en technologie die zich bezighoudt met het winnen van metalen uit hun ertsen en het omzetten daarvan in vormen die praktische waarde hebben.
Nascente zuurstof: Een allotroop van zuurstof waarvan de moleculen elk een enkel zuurstofatoom bevatten.
Ozon: Een allotroop van zuurstof die bestaat uit drie atomen per molecuul.
Producergas: Een synthetische brandstof die voornamelijk bestaat uit koolmonoxide- en waterstofgassen.
Eiwitten: Grote moleculen die essentieel zijn voor de structuur en werking van alle levende cellen.
Radioactief verval: De voorspelbare wijze waarop een populatie atomen van een radioactief element na verloop van tijd spontaan uiteenvalt.
Zuurstof
Zuurstof is een kleurloos, reukloos, smaakloos gas met een smeltpunt van -218°C (-360°F) en een kookpunt van -183°C (-297°F). Het is het meest voorkomende element in de aardkorst, dat ongeveer een kwart van het gewicht van de atmosfeer uitmaakt, ongeveer de helft van de lithosfeer (aardkorst), en ongeveer 85 procent van de hydrosfeer (de oceanen, meren, en andere vormen van water). Het komt zowel voor als vrij element als in een grote verscheidenheid van verbindingen. In de atmosfeer komt het voor als elementair zuurstof, soms ook wel dio-zuurstof genoemd omdat het uit twee-atomige moleculen bestaat, O 2 . In water komt het voor als waterstofoxide, H 2 O, en in de lithosfeer komt het voor in verbindingen als oxiden, carbonaten, sulfaten, silicaten, fosfaten en nitraten.
Zuurstof bestaat ook in twee allotrope vormen (fysisch of chemisch verschillende vormen van dezelfde stof): één atoom per molecuul (O) en drie atomen per molecuul (O 3 ). De eerstgenoemde allotroop staat bekend als mono-atomair zuurstof en de laatstgenoemde als trio-atomair zuurstof of ozon. Onder de meeste omstandigheden in de natuur overheerst de diatomische vorm van zuurstof. In het bovenste gedeelte van de stratosfeer echter veroorzaakt zonne-energie de afbraak van de diatome vorm in de monatome vorm, die vervolgens kan recombineren met diatome moleculen om ozon te vormen. De aanwezigheid van ozon in de atmosfeer van de aarde is van cruciaal belang voor het voortbestaan van het leven op aarde, aangezien deze allotroop de neiging heeft ultraviolette straling te absorberen die anders schadelijk of zelfs dodelijk zou zijn voor zowel plantaardig als dierlijk leven op het aardoppervlak.
Zuurstof werd onafhankelijk van elkaar ontdekt door de Zweedse scheikundige Carl Scheele (1742-1786) en de Engelse scheikundige Joseph Priestley (1733-1804) in de periode tussen 1773 en 1774. Het element kreeg zijn naam aan het eind van de jaren 1770 van de Franse scheikundige Antoine Laurent Lavoisier (1743-1794). De naam is afgeleid van het Franse woord voor “zuurvormer”, waarmee Lavoisier aangeeft dat hij ten onrechte dacht dat alle zuren zuurstof bevatten.
Productie. Verreweg de meest gangbare methode voor de commerciële productie van zuurstof is de gefractioneerde destillatie van vloeibare lucht. Een luchtmonster wordt eerst afgekoeld tot een zeer lage temperatuur in het bereik van -200°C (-330°F). Bij deze temperatuur worden de meeste gassen waaruit lucht bestaat vloeibaar. Vervolgens laat men de vloeibare lucht verdampen. Bij een temperatuur van ongeveer -196°C (-320°F) begint stikstof te koken. Wanneer het grootste deel van de stikstof is verdwenen, koken ook argon en neon weg, waardoor een onzuivere vorm van zuurstof overblijft. De zuurstof is onzuiver omdat kleine hoeveelheden krypton, xenon en andere gassen in de vloeibare vorm kunnen achterblijven. Om de zuurstof verder te zuiveren, kan het proces van afkoelen, vloeibaar maken en verdampen worden herhaald.
Zuurstof wordt over het algemeen opgeslagen en vervoerd in vloeibare vorm, een vorm die ook bekend staat als LOX (voor l iquid ox ygen). LOX-containers zien eruit als zeer grote vacuümflessen die bestaan uit een dubbelwandige houder met een vacuüm tussen de wanden. Het element kan ook minder gemakkelijk in gasvormige vorm worden opgeslagen en vervoerd in staalwandige houders van ongeveer 1,2 meter hoog en 23 centimeter (9 inches) in diameter. In veel gevallen wordt zuurstof vervaardigd op de plaats waar het zal worden gebruikt. Het eerder beschreven proces van gefractioneerde distillatie is eenvoudig en goedkoop genoeg, zodat veel industrieën hun eigen zuurstofproductiefaciliteiten kunnen verzorgen.
Toepassingen. Zuurstof kent zoveel commerciële, industriële en andere toepassingen dat het qua productievolume in de Verenigde Staten steevast in de top vijf van chemische stoffen staat. In 1990 bijvoorbeeld werd in de Verenigde Staten ongeveer 18 miljard kilogram (39 miljard pond) van het element vervaardigd.
De toepassingen van zuurstof kunnen in vier grote categorieën worden ingedeeld: metallurgie, rakettechniek, chemische synthese en geneeskunde. Bij de verwerking van ijzererts in een hoogoven, bijvoorbeeld, wordt zuurstof gebruikt om cokes (koolstof) om te zetten in koolmonoxide. De koolmonoxide reduceert op zijn beurt ijzeroxiden tot zuiver ijzermetaal. Zuurstof wordt vervolgens gebruikt in een tweede stap van de ijzerverwerking in de Bessemer convertor, open haard, of basiszuurstofprocesmethode om “ruwijzer” om te zetten in staal. In deze stap wordt de zuurstof gebruikt om te reageren met de overtollige koolstof, silicium en metalen die in het ruwijzer zijn achtergebleven en die moeten worden verwijderd om staal te produceren.
Een andere metallurgische toepassing van zuurstof is te vinden in lastoortsen die worden gebruikt bij lassen en snijden. De twee meest gebruikte toortsen maken gebruik van de reactie tussen zuurstof en waterstof (de oxyhydrogen toorts) of tussen zuurstof en acetyleen (de oxyacetylene toorts). Beide soorten toortsen produceren temperaturen in het bereik van 3.000°C (5.400°F) of meer en kunnen daarom worden gebruikt voor het doorsnijden of lassen van de grote meerderheid van metalen materialen.
Zuurstof in de vorm van LOX wordt op grote schaal gebruikt als oxidatiemiddel in vele soorten raketten. Zo bevat de enorme externe brandstoftank die nodig is om het ruimteveer in de ruimte te brengen, 550.000 liter vloeibare zuurstof en 1.500.000 liter vloeibare waterstof. Wanneer deze twee elementen reageren in de hoofdmotoren van het ruimteveer, leveren zij een maximale stuwkracht van 512.000 pond.
De chemische industrie gebruikt elk jaar enorme hoeveelheden zuurstof in een verscheidenheid van chemische synthesereacties (vorming). Een van de belangrijkste daarvan is het kraken van koolwaterstoffen door zuurstof. Onder de meeste omstandigheden leidt verhitting van een koolwaterstof met zuurstof tot verbranding, met kooldioxide en water als de belangrijkste producten. Als de snelheid waarmee zuurstof aan een koolwaterstofmengsel wordt toegevoerd echter zorgvuldig wordt geregeld, wordt de koolwaterstof “gekraakt”, of uit elkaar gehaald om andere producten te produceren, zoals acetyleen, ethyleen en propyleen.
Er kunnen ook verschillende soorten synthetische brandstoffen worden vervaardigd met zuurstof als een van de belangrijkste reactanten. Produceergas, bijvoorbeeld, wordt vervaardigd door zuurstof in een gecontroleerd tempo door een bed van hete steenkool of cokes te laten stromen. Het grootste deel van het bij deze reactie geproduceerde kooldioxide wordt gereduceerd tot koolmonoxide, zodat het eindproduct (het producentengas) hoofdzakelijk bestaat uit koolmonoxide en waterstof.
De bekendste medische toepassing van zuurstof is wellicht de zuurstoftherapie, waarbij patiënten die moeite hebben met ademhalen doses zuivere of bijna zuivere zuurstof toegediend krijgen. Zuurstoftherapie wordt vaak toegepast bij chirurgische ingrepen, bij bevallingen, bij herstel na een hartaanval en bij de behandeling van infectieziekten. In alle gevallen vermindert de toediening van zuivere zuurstof de druk op hart en longen, waardoor het herstel sneller verloopt.
Zuurstof of lucht verrijkt met zuurstof kan ook worden toegediend in omgevingen waar ademhalen moeilijk kan zijn. Vliegtuigen die op grote hoogte vliegen, zijn natuurlijk altijd voorzien van voorraden zuurstof in geval van problemen met de normale luchttoevoer van het schip. Ook diepzeeduikers hebben een voorraad met zuurstof verrijkte lucht bij zich of laten die naar hen pompen.
Sommige waterzuiverings- en rioolwaterzuiveringsinstallaties maken gebruik van zuurstof. Het gas wordt door het water gepompt om de snelheid te verhogen waarmee natuurlijk voorkomende bacteriën organisch afval afbreken. Een soortgelijk proces blijkt de eutrofiëring in meren en vijvers te verminderen en in sommige gevallen zelfs om te keren. (Eutrofiëring is het oplossen van voedingsstoffen in een waterlichaam. Groei van waterplanten en afname van opgeloste zuurstof zijn de twee belangrijkste resultaten van dit proces).
Zuurstof, ten slotte, is essentieel voor al het dierlijke leven op aarde. Een mens kan een paar dagen of weken zonder water of voedsel overleven, maar niet langer dan een paar minuten zonder zuurstof. Bij gebrek aan zuurstof zouden de chemische reacties die in de cellen energie opwekken, stoppen en zou een mens sterven.
Zwavel
Zwavel is een niet-metaalelement dat in vele allotrope vormen (fysisch of chemisch verschillende vormen van dezelfde stof) kan bestaan. De bekendste worden rhombische en monoklinische zwavel genoemd. Beide zijn heldergele vaste stoffen met smeltpunten van ongeveer 115°C (239°F). Een derde vorm heet plastische of amorfe zwavel. Het is een bruinachtige vloeistof die ontstaat wanneer rhombisch of monoklien zwavel wordt gesmolten.
Zwavel zelf heeft geen enkele geur. Het heeft in dit opzicht echter een slechte reputatie, omdat sommige van zijn meest voorkomende verbindingen een sterke geur hebben. Zwaveldioxide, een van deze verbindingen, heeft een scherp, verstikkend, verstikkend effect op iedereen die het inademt. Het “vuur en zwavel” uit de Bijbel was een van de ergste straffen die de schrijvers zich konden voorstellen. De zwavel in deze uitdrukking verwees naar brandende zwavel, of zwaveldioxide. Het feit dat zwavel van diep onder de grond komt en dat zwaveldioxide kan worden geroken in de dampen van vulkanen, voedde de verbeelding van de mensen over hoe de hel er uit moest zien.
Een tweede zwavelverbinding met een slechte geur is waterstofsulfide. De sterke geur van rotte eieren is te wijten aan de aanwezigheid van deze verbinding.
Voorkomen en bereiding. Zwavel is het zestiende element dat het meest voorkomt in de aardkorst. Het komt zowel als element als in een verscheidenheid van verbindingen voor. Als element kan het worden gevonden in zeer grote, ondergrondse mijnen, meestal langs de Golfkust van de Verenigde Staten en in Polen en Sicilië. De zwavel wordt uit deze mijnen gewonnen door middel van het Frasch-proces. Bij dit proces wordt oververhitte stoom door de buitenste van drie pijpen gepompt. Samengeperste lucht wordt door de binnenste pijp geperst. De oververhitte stoom doet de ondergrondse zwavel smelten, en de samengeperste lucht drijft de zwavel omhoog, door de middelste van de drie pijpen, naar de oppervlakte van de aarde.
Zwavel komt ook op grote schaal voor in de vorm van mineralen en ertsen. Veel daarvan zijn in de vorm van sulfaten, waaronder gips (calciumsulfaat, MgSO 4 ), bariet (bariumsulfaat, MgSO 4 ), en Epsomzouten (magnesiumsulfaat, MgSO 4 ). Andere zijn metaalsulfiden, waaronder ijzerpyrites (ijzersulfide, FeS 2 ), galena (loodsulfide, PbS), cinnaber (kwiksulfide, HgS), stibniet (antimoniumsulfide, Sb 2 S 3 ), en zinkblende (zinksulfide, ZnS). De zwavel wordt uit deze metaalertsen teruggewonnen door ze sterk te verhitten in lucht, waardoor de zwavel wordt omgezet in zwaveldioxide en het zuivere metaal vrijkomt. Vervolgens kan het zwaveldioxide rechtstreeks worden gebruikt voor de vervaardiging van zwavelzuur, waar meer dan 90 procent van de in de wereld gewonnen zwavel terechtkomt.
Toepassingen van zwavel en zwavelverbindingen. Sommige zwavelsoorten worden rechtstreeks gebruikt als schimmel- en insecticide, in lucifers, vuurwerk en buskruit, en bij het vulkaniseren van natuurlijk rubber (een behandeling die rubber elasticiteit en sterkte geeft). Het meeste wordt echter omgezet in een groot aantal nuttige verbindingen.
Zwavelzuur is verreweg de belangrijkste van alle zwavelverbindingen. Bijna 90 procent van alle geproduceerde zwavel wordt eerst omgezet in zwaveldioxide en vervolgens in zwavelzuur. Het zuur staat steevast op de eerste plaats van de chemische producten die in de Verenigde Staten worden geproduceerd. In 1990 werd meer dan 40 miljard kilogram (89 miljard pond) zwavelzuur geproduceerd, meer dan 50 procent zoveel als de op één na populairste chemische stof (stikstofgas). Zwavelzuur wordt gebruikt bij de productie van meststoffen, autoaccu’s, aardolieproducten, pigmenten, ijzer en staal, en vele andere producten.
De zwavelcyclus. Net als stikstof, koolstof en fosfor doorloopt zwavel de gasvormige, vloeibare en vaste delen van onze planeet in een reeks voortdurende reacties die bekend staat als de zwavelcyclus. De belangrijkste stappen in de zwavelcyclus worden geïllustreerd in de bijgaande figuur.
Zwavel wordt op natuurlijke wijze geproduceerd als gevolg van vulkaanuitbarstingen en door emissies uit hete bronnen. Het komt vooral in de vorm van zwaveldioxide in de atmosfeer terecht en blijft dan in die vorm of, na een reactie met water, in de vorm van zwavelzuur in de atmosfeer achter. Zwavel wordt bij regen of sneeuw als zure neerslag meegevoerd naar het aardoppervlak.
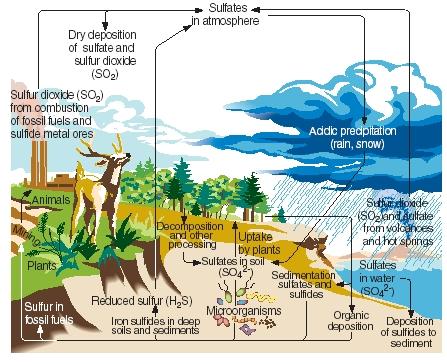
.)
Aan het aardoppervlak reageren zwaveldioxide en zwavelzuur met metalen om sulfaten en sulfiden te vormen. Het element wordt ook door planten opgenomen in een vorm die bekend staat als organische zwavel. Bepaalde aminozuren, de verbindingen waaruit eiwitten worden gemaakt, bevatten zwavel. Organische zwavel uit planten wordt uiteindelijk doorgegeven aan dieren die deze planten eten. Het wordt op zijn beurt omgezet van plantaardige eiwitten in dierlijke eiwitten.
Als planten en dieren sterven, gaat de zwavel terug naar de bodem, waar hij door micro-organismen wordt omgezet in waterstofsulfide. Waterstofsulfidegas gaat vervolgens terug naar de atmosfeer, waar het wordt geoxideerd tot zwavelzuur.
Menselijke activiteiten beïnvloeden de zwavelcyclus op een aantal manieren. Bij de winning van steenkool en metaalertsen bijvoorbeeld, kunnen zwavel en sulfiden vrijkomen en weer in de bodem terechtkomen. Ook bij de verbranding van kolen, olie en aardgas komt vaak zwaveldioxide in de atmosfeer terecht. Dit zwaveldioxide wordt toegevoegd aan de hoeveelheid die reeds aanwezig is uit natuurlijke bronnen, waardoor de hoeveelheid zure neerslag die op het aardoppervlak valt, sterk toeneemt. Sommige mensen geloven dat zure neerslag (of zure regen) verantwoordelijk is voor de dood van bomen en andere planten, de verzuring van meren die zeedieren heeft geschaad, schade aan metalen en stenen constructies, en andere milieuschade.
Selenium, tellurium en polonium
Selenium en tellurium zijn beide betrekkelijk zeldzame elementen. Zij behoren qua abundantie tot de laatste tien procent van alle elementen. Zij komen in de aardkorst voor in combinatie met ertsen van koper en andere metalen. Beide worden verkregen als bijproduct bij de elektrolytische raffinage van koper. Tijdens dat proces zinken zij naar de bodem van de elektrolysetank, waar zij kunnen worden verwijderd uit het slib dat ontstaat.
Selenium komt voor in een verscheidenheid van allotrope vormen (fysisch of chemisch verschillende vormen van dezelfde stof), waarvan de meest voorkomende een rood poeder is dat zwart wordt wanneer het aan de lucht wordt blootgesteld. Het smeltpunt van het element is 217°C, en het kookpunt is 685°C. Tellurium is een zilverwitte vaste stof die eruitziet als een metaal (hoewel het eigenlijk een metalloïde is). Het smeltpunt is 450°C, en het kookpunt is 990°C.
Selenium heeft een interessante rol in levende organismen. Het is essentieel in zeer lage concentraties voor het behoud van de gezondheid van de meeste dieren. Het wordt dan ook vaak toegevoegd aan diervoeders. In hogere concentraties blijkt het element echter schadelijke effecten te hebben op dieren, met misvormde jongen en zieke volwassenen tot gevolg.
Selenium wordt vooral gebruikt in de elektronica en bij de fabricage van gekleurd glas. Fotokopieermachines, zonnecellen, fotocellen, beeldbuizen van televisies en elektronische gelijkrichters en relais (die worden gebruikt om de stroom van elektrische stroom te regelen) maken allemaal gebruik van selenium. Sommige van de mooist gekleurde glazen, variërend van lichtroze tot schitterend rood, worden gemaakt met verbindingen van selenium.
Bij de produktie van gekleurd glas worden ook kleine hoeveelheden tellurium gebruikt. Meer dan 90 procent van het element gaat echter naar de produktie van legeringen van ijzer en andere metalen.
Polonium heeft 27 isotopen, die alle radioactief zijn. Het komt van nature voor in uraniumertsen, waar het het eindproduct is in de lange reeks reacties waarbij uranium radioactief verval ondergaat. Het is een van de zeldzaamste elementen op aarde, met een abondantie van niet meer dan ongeveer 3 × 10 -10 deeltjes per miljoen. De ontdekking van polonium in 1898 door de Pools-Franse scheikundige Marie Curie (1867-1934) is een van de meest dramatische verhalen in de geschiedenis van de wetenschap. Zij verwerkte tonnen uraniumerts om een paar milligram van het nieuwe element te verkrijgen, dat zij vervolgens naar haar vaderland Polen vernoemde. Polonium wordt in beperkte mate gebruikt in zeer gespecialiseerde energieopwekkende apparaten, zoals die voor ruimtesatellieten en ruimtesondes worden gebruikt.