19.1: Polypeptides and Proteins
Learning Objectives
- Define or describe the following:
- amino acid
- „R“ group
- peptide bond
- peptide
- polypeptide
- primary protein structure
- secondary protein structure
- tertiary protein structure
- quaternary protein structure
- gene
- Describe how the primary structure of a protein or polypeptide ultimately detemines its final three-dimensional shape.
- Describe how the order of nucleotide bases in DNA ultimately determines the final three-dimensional shape of a protein or polypeptide.
Amino acids are the building blocks for proteins. All amino acids contain an amino or NH2 group and a carboxyl (acid) or COOH group. There are 20 different amino acids commonly found in proteins and often 300 or more amino acids per protein molecule. Každá aminokyselina se liší svou skupinou „R“. Skupina „R“ aminokyseliny je zbytek molekuly, tj. část jiná než aminoskupina, kyselá skupina a centrální uhlík. Každá aminokyselina má jedinečnou „R“ skupinu a jedinečné chemické vlastnosti aminokyseliny závisí na její „R“ skupině (obrázek \(\PageIndex{1}\)).
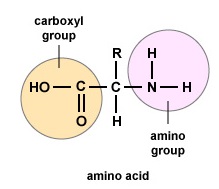
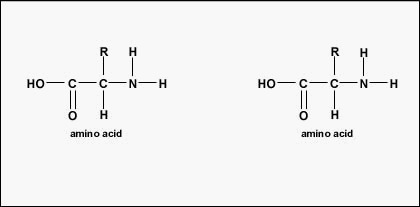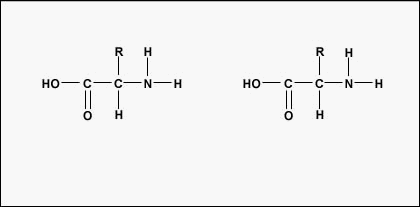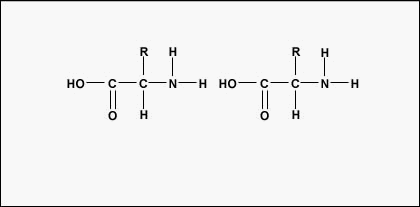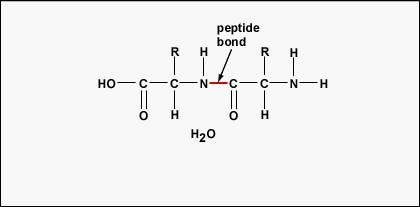
Aminokyseliny se pro vytvoření polypeptidů a proteinů spojují peptidovými vazbami, v nichž se amino nebo NH2 jedné aminokyseliny váže na karboxylovou (kyselou) nebo COOH skupinu jiné aminokyseliny, jak je znázorněno na (Figure \(\PageIndex{2}\) a Figure \(\PageIndex{3}\).
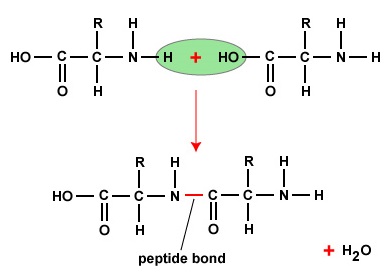
Peptid jsou dvě nebo více aminokyselin spojených peptidovými vazbami a polypeptid je řetězec mnoha aminokyselin. Protein obsahuje jeden nebo více polypeptidů. Proteiny jsou tedy dlouhé řetězce aminokyselin držené pohromadě peptidovými vazbami.
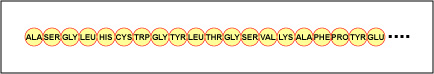
Skutečné pořadí aminokyselin v bílkovině se nazývá její primární struktura (obrázek \(\PageIndex{4}\)) a je určeno DNA. Jak uvidíte později v této kapitole, DNA se dělí na funkční jednotky zvané geny. Gen je sekvence deoxyribonukleotidových bází podél jednoho vlákna DNA, která kóduje funkční produkt – specifickou molekulu messengerové RNA, transferové RNA nebo ribozomální RNA. Produktem je obvykle messengerová RNA (mRNA) a mRNA nakonec vede k syntéze polypeptidu nebo proteinu. Proto se běžně říká, že pořadí deoxyribonukleotidových bází v genu určuje aminokyselinovou sekvenci konkrétního proteinu. Protože některé aminokyseliny mohou interagovat s jinými aminokyselinami v téže bílkovině, určuje tato primární struktura v konečném důsledku konečný tvar, a tedy chemické a fyzikální vlastnosti bílkoviny.
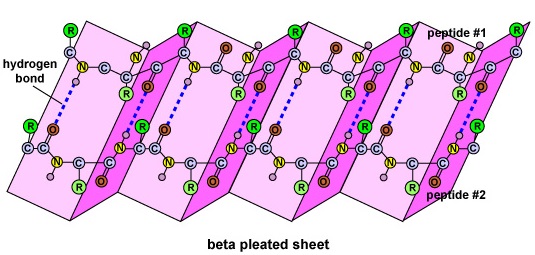
Sekundární struktura bílkoviny je způsobena vodíkovými vazbami, které vznikají mezi atomem kyslíku jedné aminokyseliny a atomem dusíku druhé. Díky tomu má protein nebo polypeptid dvojrozměrnou podobu alfa-helixu nebo beta-skládaného listu (obrázek \(\PageIndex{5}\)).
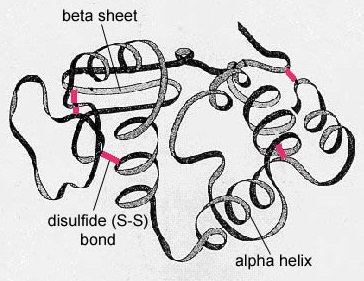
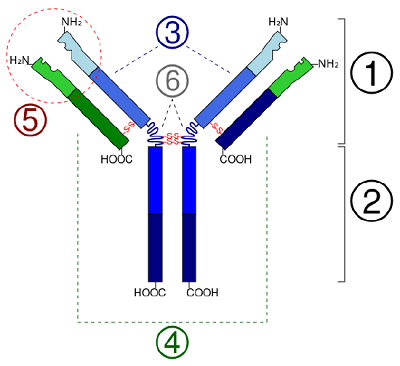
U globulárních proteinů, jako jsou enzymy, se dlouhý řetězec aminokyselin skládá do trojrozměrného funkčního tvaru neboli terciární struktury. Je to proto, že některé aminokyseliny se sulfhydrylovými nebo SH skupinami vytvářejí disulfidové (S-S) vazby s jinými aminokyselinami ve stejném řetězci. K terciární struktuře přispívají i další interakce mezi R skupinami aminokyselin, jako jsou vodíkové vazby, iontové vazby, kovalentní vazby a hydrofobní interakce (obrázek \(\PageIndex{6}\)). V některých bílkovinách, jako jsou molekuly protilátek a hemoglobin, se může několik polypeptidů spojit a vytvořit kvartérní strukturu (obrázek \(\PageIndex{7}\)).
Jak uvidíte později v této kapitole, během syntézy bílkovin se pořadí nukleotidových bází podél genu přepisuje do komplementárního řetězce mRNA, který je pak pomocí tRNA přeložen do správného pořadí aminokyselin pro daný polypeptid nebo bílkovinu. Pořadí deoxyribonukleotidových bází podél DNA tedy určuje pořadí aminokyselin v bílkovinách. Protože některé aminokyseliny mohou interagovat s jinými aminokyselinami, určuje pořadí aminokyselin pro každý protein jeho konečný trojrozměrný tvar, který zase určuje funkci daného proteinu (např, s jakým substrátem bude reagovat enzym, s jakými epitopy se spojí Fab protilátky, na jaké receptory se naváže cytokin).
Shrnutí
- Aminokyseliny jsou stavebními kameny proteinů. V bílkovinách se běžně vyskytuje 20 různých aminokyselin a v jedné molekule bílkoviny je často 300 i více aminokyselin.
- Všechny aminokyseliny obsahují aminoskupinu neboli NH2 a karboxylovou (kyselou) skupinu neboli COOH.
- Pro vytvoření polypeptidů a bílkovin se aminokyseliny spojují peptidovými vazbami, v nichž se amino nebo NH2 jedné aminokyseliny váže na karboxylovou (kyselou) nebo COOH skupinu jiné aminokyseliny.
- Peptid jsou dvě nebo více aminokyselin spojených peptidovými vazbami; polypeptid je řetězec mnoha aminokyselin; a bílkovina obsahuje jeden nebo více polypeptidů. Proteiny jsou tedy dlouhé řetězce aminokyselin držené pohromadě peptidovými vazbami.
- Skutečné pořadí aminokyselin v proteinu se nazývá jeho primární struktura a je určeno DNA.
- Pořadí deoxyribonukleotidových bází v genu určuje sekvenci aminokyselin konkrétního proteinu. Protože některé aminokyseliny mohou interagovat s jinými aminokyselinami v téže bílkovině, určuje tato primární struktura v konečném důsledku konečný tvar, a tedy chemické a fyzikální vlastnosti bílkoviny.
- Sekundární struktura bílkoviny je způsobena vodíkovými vazbami, které vznikají mezi atomem kyslíku jedné aminokyseliny a atomem dusíku jiné aminokyseliny a dávají bílkovině nebo polypeptidu dvourozměrný tvar alfa-helixu nebo beta-skládaného listu.
- U globulárních bílkovin, jako jsou enzymy, se dlouhý řetězec aminokyselin skládá do trojrozměrného funkčního tvaru neboli terciární struktury. Je to proto, že některé aminokyseliny se sulfhydrylovými nebo SH skupinami vytvářejí disulfidové (S-S) vazby s jinými aminokyselinami ve stejném řetězci. K terciární struktuře přispívají i další interakce mezi R skupinami aminokyselin, jako jsou vodíkové vazby, iontové vazby, kovalentní vazby a hydrofobní interakce.
- In some proteins, such as antibody molecules, several polypeptides may bond together to form a quaternary structure.
Contributors and Attributions
-
Dr. Gary Kaiser (COMMUNITY COLLEGE OF BALTIMORE COUNTY, CATONSVILLE CAMPUS)