4. Silné a slabé báze
Slabé báze
Amoniak je typickou slabou bází. Amoniak sám o sobě samozřejmě neobsahuje hydroxidové ionty, ale reaguje s vodou za vzniku amonných a hydroxidových iontů.
Reakce je však vratná a v každém okamžiku je přibližně 99 % amoniaku stále přítomno ve formě molekul amoniaku. Pouze asi 1 % skutečně vytvořilo hydroxidové ionty. Slabá zásada je taková, která se v roztoku plně nepřeměňuje na hydroxidové ionty. Při reakci slabé zásady s vodou se poloha rovnováhy u jednotlivých zásad liší. Čím více vlevo, tím je zásada slabší.
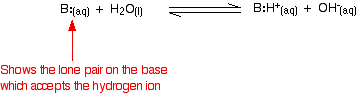
Míru polohy rovnováhy můžete získat zápisem rovnovážné konstanty pro danou reakci. Čím nižší je hodnota konstanty, tím více leží rovnováha vlevo. V tomto případě se rovnovážná konstanta nazývá Kb. Ta je definována jako:
\}{}\]
The relationship between Kb and pKb is exactly the same as all the other „p“ terms in this topic:
\
The table shows some values for \(K_b\) and \(pK_b\) for some weak bases.
| base | Kb (mol dm-3) | pKb |
|---|---|---|
| C6H5NH2 | 4.17 x 10-10 | 9.38 |
| NH3 | 1.78 x 10-5 | 4.75 |
| CH3NH2 | 4.37 x 10-4 | 3.36 |
| CH3CH2NH2 | 5.37 x 10-4 | 3.27 |