Adipocyty
Adipocyty jsou hlavními zásobárnami energie v těle a mají také důležité endokrinní funkce. Proto je pochopení vývoje a funkce adipocytů – zejména ve světle pandemie obezity – zásadní pro pochopení metabolické homeostázy. Existují dvě obecné třídy adipocytů: bílé adipocyty, které uchovávají energii v podobě jediné velké lipidové kapičky a mají důležité endokrinní funkce, a hnědé adipocyty, které uchovávají energii ve více malých lipidových kapičkách, ale speciálně pro použití jako palivo k tvorbě tělesného tepla (tj. termogeneze). Produkce tepla hnědými adipocyty je umožněna jejich jedinečnou expresí mitochondriálně lokalizovaného uncoupling proteinu 1 (Ucp1). Tyto klasifikace jsou však příliš zjednodušené, protože některé bílé adipocyty mohou v závislosti na teplotě a stravě přejímat vlastnosti hnědých adipocytů (označovaných jako brite nebo beige adipocytes) a naopak. Zajímá nás pochopení původu různých adipocytů a definování signálních a metabolických drah, které řídí jejich vývoj, distribuci a funkci.
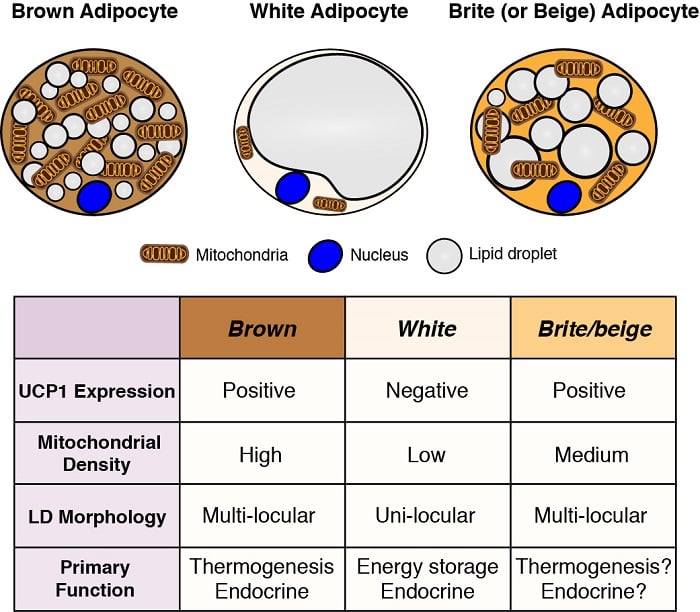
Původ adipocytů
Ústředním předpokladem pro pochopení úlohy tukové tkáně ve zdraví a nemoci je porozumět tomu, jak roste, a v tomto ohledu je jednou z nejméně probádaných oblastí biologie tukové tkáně vývojový původ různých typů adipocytů. Definování původu adipocytů by mohlo pomoci vysvětlit vzorce rozložení tuku v lidském těle, zejména u obézních nebo lipodystrofických jedinců, a může poskytnout vodítko k metabolickým rozdílům pozorovaným mezi některými tukovými depoty. Identifikace prekurzorových buněk adipocytů a mechanismů regulujících jejich expanzi má rovněž zásadní význam pro pochopení a řízení zdravé funkce tukové tkáně. Může být také možné inženýrsky vyvinout „zdravé“ adipocyty (jako jsou hnědé nebo bílé/béžové adipocyty) z prekurzorů pro buněčné terapie zaměřené v podstatě na boj s tukem pomocí tuku. Pomocí kombinace genetiky a strategie sledování linií jsme již dříve zmapovali původ adipocytů sídlících v různých depotech. Naše výsledky odhalují nečekanou míru heterogenity, která odpovídá tomu, že adipocyty mají více vývojových původů, a podporují model, v němž osud adipocytů pravděpodobně závisí na vnějších i vnitřních faktorech.
Adipocyty mají více vývojových původů
(vlevo dole) Anatomické rozložení depotů tukové tkáně u myši. Zobrazena jsou depa hnědé tukové tkáně (BAT) a bílé tukové tkáně (WAT). (vpravo dole) Příklad experimentu sledování linie, během kterého byly vývojové prekurzorové buňky a všichni jejich potomci nesmazatelně označeni fluorescenční značkou spojenou s expresí Myf5 (panel a) nebo Pax3 (panel b). Adipocyty označené zeleně (mGFP) pocházejí z jiné prekurzorové buňky než adipocyty označené červeně (mTFP).
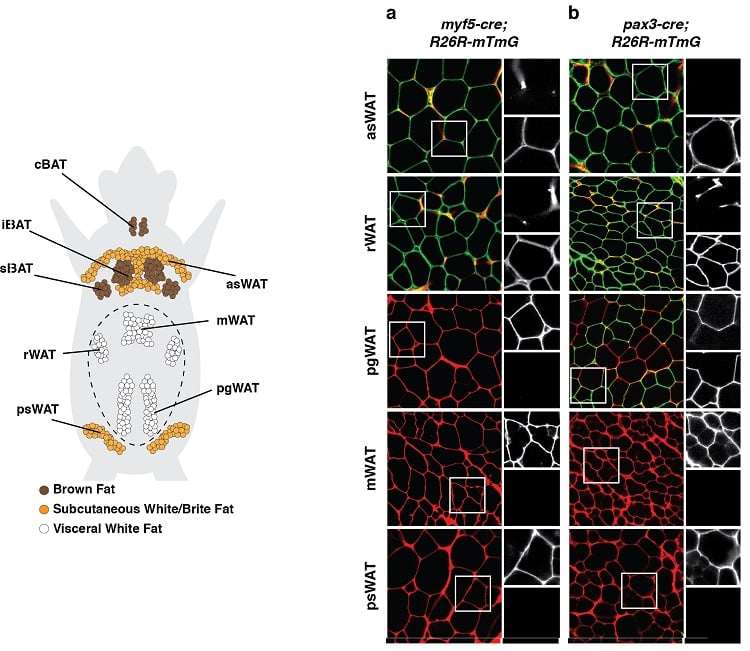
Takové výsledky naznačují, že adipocyty mají více vývojových původů.
(převzato z publikace Sanchez-Gurmaches & Guertin, Nature Communications 2014; Sanchez-Gurmaches et al., Trends in Cell Biology 2016).
Hnědé adipocyty
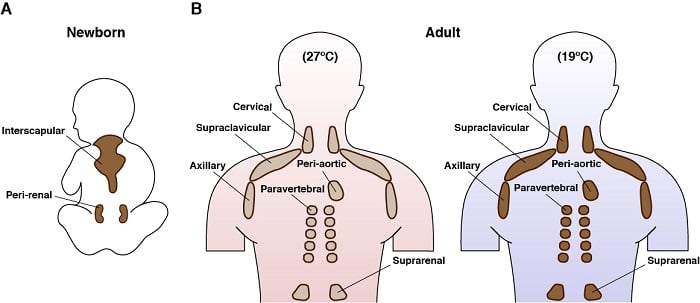
Hnědé adipocyty jsou fascinující buňky. Existují pouze u savců a jejich hlavní funkcí je tvorba endogenního tepla v procesu zvaném termogeneze. To je umožněno jejich jedinečnou expresí mitochondriálního membránového proteinu zvaného uncoupling protein 1 (UCP1). Energetické vlastnosti hnědého tuku a nedávné zjištění, že hnědý tuk mají i dospělí lidé, z něj učinily cíl terapie zaměřené na boj proti nadměrné výživě. Aktivní hnědé adipocyty mají také jeden z nejzajímavějších metabolických programů: přijímají a spotřebovávají současně velké množství různorodých živin (např. glukózy, lipidů, aminokyselin) a mohou současně zapojit anabolický i katabolický metabolismus. My a další jsme například dříve ukázali, že BAT stimulované chladem široce upregulují genetický program, který kromě cest oxidace mastných kyselin podporuje i cesty syntézy de novo lipidů . Rádi bychom tomuto pozoruhodnému a paradoxnímu metabolismu porozuměli více.
Zjistěte více o vývoji a metabolismu hnědé tukové tkáně
Anatomické umístění hnědého tuku u člověka
K výzkumu toho, jak signální dráhy řídí metabolismus BAT, používáme také genetické modely. Například pomocí myší jsme geneticky odstranili Rictor – který kóduje jedinečnou a nezbytnou součást mTORC2 – pouze v hnědé tukové tkáni. Další informace o mTORC2. Pozoruhodné je, že tyto myši jsou chráněny před stravou s vysokým obsahem tuku. Přesněji řečeno, myši bez BAT Rictoru nehromadily nadměrné množství lipidů v játrech nebo v depotech viscerální tukové tkáně, když jedly stravu s vysokým obsahem tuku . To je vzrušující zjištění, protože nadměrné ukládání lipidů v těchto místech je nebezpečně nezdravé. Pomocí kombinace genetiky, genomiky, metabolomiky a biochemie se snažíme pochopit, proč jsou tyto myši chráněny před stravou s vysokým obsahem tuku.
Bílé adipocyty
Bílé adipocyty jsou nejhojněji zastoupenými adipocyty u lidí. Depa bílé tukové tkáně mají také pozoruhodnou schopnost expandovat a ukládat energii a vysílají signály do mozku a dalších tkání, čímž silně ovlivňují potravní chování a metabolickou homeostázu. Avšak i když jsou bílé adipocyty specificky uzpůsobeny k bezpečnému uzamykání přebytečných živin, mají bod zlomu (např. při obezitě), kdy jejich prospěšné funkce selhávají, a to silně podporuje vznik metabolického onemocnění a diabetu 2. typu. Co definuje bod zvratu? Jak bílé adipocyty signalizují ostatním tkáním? Jak heterogenní jsou depa bílé tukové tkáně? Proč je nadbytek viscerálního tuku pro zdraví škodlivější než nadbytek podkožního tuku? To vše jsou nevyřešené otázky, které nás zajímají.
Studujeme také signalizaci mTOR v bílých adipocytech. mTOR je hlavním následným cílem signalizace inzulínu, což je hlavní hormon, na který adipocyty reagují. Pomocí genetických myších modelů jsme selektivně inhibovali buď mTORC1, nebo mTORC2 ve všech adipocytech. Inhibice mTORC1 v bílé tukové tkáni způsobuje syndrom podobný lipodystrofii spojený s inzulinovou rezistencí a tukovým onemocněním jater. Inhibice mTORC2 v bílé tukové tkáni rovněž způsobuje inzulinovou rezistenci, ale nezávisle na změnách hmotnosti tukové tkáně. V posledně jmenovaném modelu mTORC2 zřejmě reguluje signál pocházející z adipocytů, který komunikuje s játry a řídí jaterní produkci glukózy. Pochopení mechanistického základu těchto fenotypů poskytne zásadní informace o tom, jak dráhy přenosu signálu vnímající živiny přispívají k patogenezi onemocnění souvisejících s tukovou tkání.
Model signalizace mTORC2 v bílém adipocytu
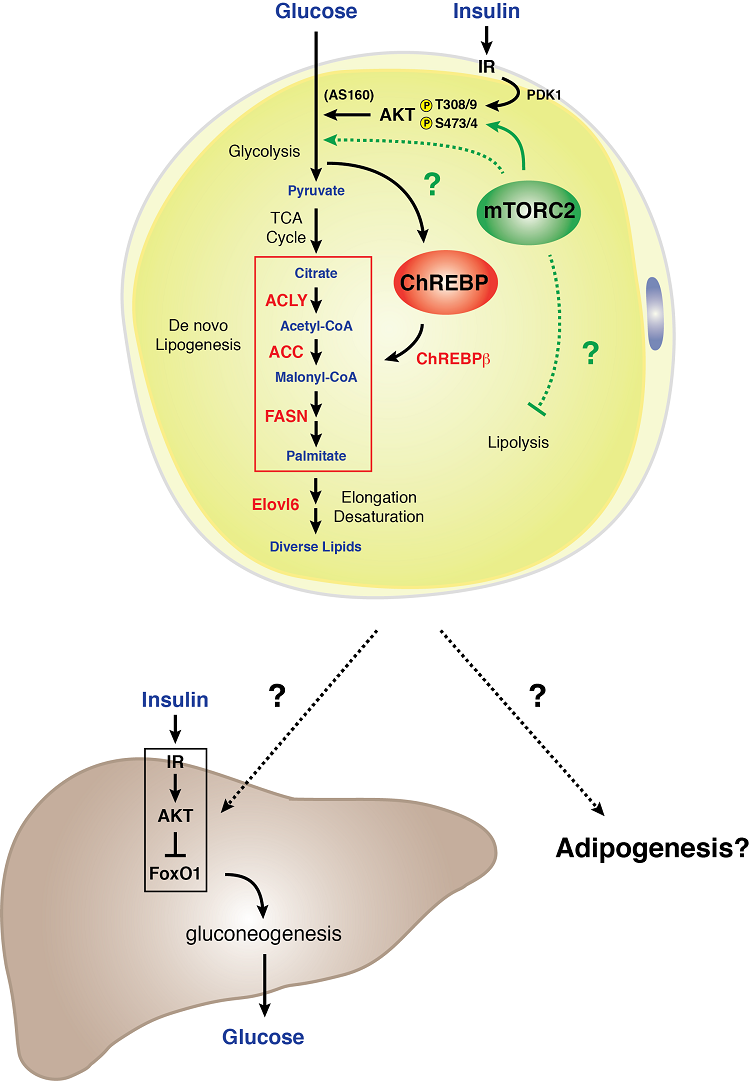 Bílé adipocyty vyžadují mTORC2 pro normální metabolismus sacharidů a lipidů. Zjistili jsme, že genetická ztráta rictoru (mTORC2) specificky v bílých adipocytech snižuje příjem glukózy a oslabuje expresi transkripčního faktoru ChREBP-beta a jeho následných cílů – což zahrnuje enzymy, které fungují v dráze de novo lipogeneze. Deficit mTORC2 v bílých tukových buňkách navíc vede k závažné jaterní inzulínové rezistenci. Tyto údaje naznačují, že mTORC2 v bílých adipocytech je zásadním regulátorem metabolismu sacharidů a lipidů a je klíčovou součástí mimojaterního komunikačního mechanismu orgánů vnímajících živiny, který řídí systémovou homeostázu glukózy . Pochopení biologie signalizace mTORC2 v bílém tuku může být důležitým klíčem k tomu, jak bílá tuková tkáň funguje jako orgán vnímající glukózu a zprostředkovatel systémové metabolické kondice.
Bílé adipocyty vyžadují mTORC2 pro normální metabolismus sacharidů a lipidů. Zjistili jsme, že genetická ztráta rictoru (mTORC2) specificky v bílých adipocytech snižuje příjem glukózy a oslabuje expresi transkripčního faktoru ChREBP-beta a jeho následných cílů – což zahrnuje enzymy, které fungují v dráze de novo lipogeneze. Deficit mTORC2 v bílých tukových buňkách navíc vede k závažné jaterní inzulínové rezistenci. Tyto údaje naznačují, že mTORC2 v bílých adipocytech je zásadním regulátorem metabolismu sacharidů a lipidů a je klíčovou součástí mimojaterního komunikačního mechanismu orgánů vnímajících živiny, který řídí systémovou homeostázu glukózy . Pochopení biologie signalizace mTORC2 v bílém tuku může být důležitým klíčem k tomu, jak bílá tuková tkáň funguje jako orgán vnímající glukózu a zprostředkovatel systémové metabolické kondice.