Aplikace geověd pro nejdůležitější výzvy Austrálie
Úvod

Hliníková fólie. Zdroj: ČSÚ, s.r.o: Wikimedia Commons
Hliník je všude kolem vás – od předmětů denní potřeby, jako je plechovka od nealkoholického nápoje, až po letadla létající nad hlavou. Hliník je jedním z nejužitečnějších materiálů, které člověk zná. Lze jej legovat (míchat) s téměř jakýmkoli jiným kovem a vytvářet tak materiály s užitečnými vlastnostmi. Všechny kovy legované hliníkem jsou velmi pevné a zároveň lehké a odolné proti korozi.
Hliník je po kyslíku a křemíku třetím nejrozšířenějším prvkem v zemské kůře (8,2 %) a zdaleka nejhojnějším kovem. Na rozdíl od kovů, jako jsou měď, zlato, olovo, železo a zinek, které lidé používají již tisíce let, se hliník běžně používá teprve něco málo přes 100 let. Je to proto, že hliník se v přírodě nikdy nevyskytuje v čistém stavu. Lidé sice znali sloučeniny hliníku, ale teprve koncem 19. století objevili, jak kovový hliník získávat.
Hliník lze (neekonomicky) získávat z některých jílů, ale nejběžnější hliníkovou rudou je materiál zvaný bauxit. Nejprve je třeba hliníkovou rudu vytěžit, poté se bauxit rafinuje na oxid hlinitý (aluminu). K tavení oxidu hlinitého na kovový hliník se spotřebuje velké množství elektřiny.
Vlastnosti
Hliník je stříbřitě zbarvený kov, který se v přírodě nikdy nevyskytuje samostatně. Je velmi lehký (asi třetina hmotnosti mědi) a přitom pevný; některé slitiny jsou dokonce pevnější než ocel. Hliník je kujný (lze jej lisovat do tvaru) i tvárný (lze jej roztloukat a táhnout do drátu). Hliník je velmi dobrým vodičem tepla a elektřiny. Je také velmi odolný proti korozi a není jedovatý. Hliník lze legovat téměř s jakýmkoli jiným kovem. Hliník je nehořlavý, nemagnetický a nejiskřící. These properties have made it an important metal in the modern world. As aluminium is such a reactive metal, you might think it would rust badly and therefore be useless. However, pure aluminium reacts very quickly with air or water to form a thin, almost invisible layer of aluminium oxide on its surface, which then acts as a protective coating preventing any further ‚rusting‘.
|
The Properties of Aluminium |
|
|---|---|
|
Chemical symbol |
Al – from the Roman word Alumen – the word for the aluminium-potassium compound alum |
|
Ore |
Bauxite |
|
Relative density |
2.7 g/cm3 |
|
Hardness |
2.75 on Mohs scale |
|
Malleability |
High |
|
Ductility |
High |
|
Melting point |
660°C |
|
Boiling Point |
2470°C |
Uses

Aluminium-bodied Austin „A40 Sports“ (c. 1951). Zdroj: Wikimedia Commons
Aluminium is smelted from alumina which is refined from bauxite ore. All three products have a number of uses.
More than 90% of the world’s bauxite production is used to make alumina with most of the remaining 10% used by the abrasive, refractory and chemical industries. Bauxite is also used in the production of high-alumina cement, as an absorbent or catalyst by the oil industry, in welding rod coatings and as a flux in making steel and ferroalloys.
Alumina’s primary use is as feedstock for aluminium smelters, however it is also used for other industrial purposes. It is used in glass, porcelain and in metallic paints, such as those sprayed on cars. Používá se také při výrobě izolátorů zapalovacích svíček, jako součást paliva pro raketové nosiče na tuhé palivo, jako plnivo do plastů, brusivo (je levnější než průmyslový diamant) a v rafineriích kovů, kde se používá k přeměně toxických odpadních plynů sirovodíku na elementární síru.
Hliník, který se vyskytuje v přírodním, krystalickém stavu, se označuje jako minerál korund. Někdy jsou krystaly korundu kontaminovány stopovým množstvím chromu, železa, titanu, mědi nebo hořčíku. Tyto krystaly nazýváme rubíny a safíry.
Hliník je po železe a oceli nejpoužívanějším kovem na Zemi. Často se leguje s mědí, zinkem, hořčíkem, manganem nebo křemíkem a přídavek malého množství zirkonia, hafnia nebo skandia do těchto slitin výrazně zvyšuje jejich pevnost. Samotný hliník má širokou škálu použití od specializovaných leteckých konstrukcí až po předměty denní potřeby, jako jsou nože a vidličky. Některá použití jsou uvedena v tabulce níže.
|
Use |
Description |
|---|---|
|
Building and construction |
Cladding, doors, window frames, awnings and bridge rails as aluminium is strong, light, easily shaped and resistant to rust. |
|
Transport |
Parts for cars, trucks, buses, aircraft, ships, rail and trams as aluminium is strong, light, easily shaped and resistant to rust. |
|
Appliances |
Fridges, washing machines, lawn mowers etc. due to its strength, malleability and rust resistance. |
|
Heating and ventilation |
Heating and cooling systems as aluminium is a good conductor of heat. |
|
Packaging |
Kitchen foil, packaging foil, cans and containers (worldwide, four out of every five drink cans are made of aluminium) as aluminium can be rolled into very thin sheets and is non-toxic. |
|
Electrical and communications |
Power transmission including towers, electrical conduits, superconductors, machinery and equipment, telephone cables and capacitors because of aluminium’s ability to conduct electricity. |
|
Other |
Utensils (cutlery, pans), industrial machinery, chemical industry, production of steel, antiperspirants, furniture, reflectors in telescopes, making high octane petrol, road signs, antacids and jewellery due to its many useful properties. |
History
Around 5300 BC: The Persians made extra strong pots from clay containing aluminium oxide.
Around 2000 BC: The ancient Egyptians and Babylonians used potassium aluminium sulphate KAl(SO4)2 as a medicine to reduce bleeding. It was sourced from naturally occurring deposits in Greece and Turkey. The ancient Romans called this medical compound „alum“, which is where we get the modern day word and symbol from. K zastavení krvácení se používá dodnes.
Středověk: Většina hliníku pocházela z papežského území Tolfa, ale jeho cena dramaticky klesla, když bylo na počátku 16. století objeveno velké ložisko hlinité břidlice v Yorkshiru. V následujících staletích se kamenec používal ve dvou hlavních oblastech: jako konzervační prostředek pro papír a jako fixační prostředek pro barvení látek.
1808: Angličan Sir Humphry Davy se pokusil získat hliník elektrolýzou. Neuspěl, ale prokázal jeho existenci a dal mu jméno.
1821: Francouzský geolog Pierre Berthier objevil poblíž vesnice Les Baux ve francouzské Provence materiál bohatý na hliník. Podle vesnice byl pojmenován bauxit.
1825:
1827: Německý chemik Friedrich Wöhler získal hliník ve formě prášku reakcí draslíku s bezvodým chloridem hlinitým, čímž zdokonalil Oerstedův postup.
1855: Francouzskému chemikovi Henri Saint-Claire Devilleovi se podařilo získat pevnou tyčinku hliníku za použití sodíku místo dražšího draslíku. Hliníková tyč byla považována za tak vzácnou, že byla téhož roku vystavena vedle francouzských korunovačních klenotů.
1886: Dva vědci na různých kontinentech (Charles Hall v Americe a Paul Heroult ve Francii) nezávisle na sobě objevili ekonomickou metodu výroby hliníku elektrolýzou v roztaveném kryolitu (fluorid sodno-hlinitý). Mimochodem, oba se narodili v roce 1864 a oba zemřeli v roce 1914.
1887:
1888: Rakouský chemik Karl Josef Bayer pracující v Rusku vyvinul metodu získávání oxidu hlinitého z bauxitu
: Hall založil Pittsburghskou redukční společnost (od roku 1907 známou jako Alcoa).
1890: Hallův-Heroultův a Bayerův objev způsobil pokles ceny hliníku o 80 %. V roce 1888 stál hliník 4,86 USD za libru. V roce 1893 stál 0,78 USD za libru a koncem 30. let 20. století stál pouhých 0,20 USD za libru a měl více než 2000 způsobů použití.
1900:

Stíhací letoun F-16 byl navržen tak, aby byl relativně levný na stavbu a jednodušší na údržbu než stíhačky dřívější generace. Drak letounu je vyroben z přibližně 80 % ze slitin leteckého hliníku, 8 % z oceli, 3 % z kompozitů a 1,5 % z titanu. Zdroj: Andy Dunaway
1911: Německý chemik Alfred Wilm vyvinul důležité slitiny hliníku, které byly dostatečně pevné pro výrobu předmětů, jako jsou letadla. Během druhé světové a korejské války byla po hliníku velká poptávka, protože letadla se dříve vyráběla ze dřeva a látky.
1922:
Hliníková fólie se začala vyrábět v roce 1955:
1958: V Bell Bay v Tasmánii byla otevřena první hliníkárna v Austrálii:
1961: poprvé byly vyrobeny hliníkové plechovky na nealkoholické nápoje:
1963: Alcoa zakládá společnost Alcoa of Australia: Alcoa of Australia otevírá první rafinerii oxidu hlinitého v Austrálii v Kwinaně v Západní Austrálii, následovanou rafinerií Pinjarra v roce 1972 a Wagerup v roce 1984.
Dnes: V roce 2016 bylo podle odhadů vyrobeno 57,6 milionu tun hliníku. To je více než všech ostatních neželezných kovů dohromady. Austrálie těží bauxit v Queenslandu, Západní Austrálii, Severním teritoriu a Tasmánii a je největším světovým producentem bauxitu. Austrálie je také světovou jedničkou ve výrobě oxidu hlinitého a hliníku. Tři západoaustralské rafinerie dodávají 45 % australského oxidu hlinitého a 11 % celosvětového množství, což z nich činí největší jednotlivý zdroj oxidu hlinitého na světě.
Tvorba

Bauxit Weipa, R30128. Pramen: Bauxit, bauxit, bauxit, bauxit, bauxit, bauxit: Geoscience Australia.
Bauxit je nejběžnější hliníková ruda. Bauxit se vyskytuje jako zvětralý pokryv nebo příkrov, známý jako laterit nebo durikrust, na různých horninách obsahujících oxid hlinitý. Vzniká, když velké množství srážek vyluhuje pohyblivější prvky z hostitelské horniny a zanechává relativně nepohyblivý hliník s trochou křemíku, železa a titanu. Vzhledem ke způsobu vzniku mohou být ložiska bauxitu velmi rozsáhlá a nacházejí se téměř na všech kontinentech.
Hlavními minerály hliníku v bauxitu jsou gibbit , boehmit a diaspor, což je polymorf (alternativní forma) boehmitu, který je však hustší a tvrdší. Čistý oxid hlinitý (Al2O3) obsahuje 52,9 % hliníku a 47,1 % kyslíku. Bauxit může být velmi tvrdý nebo měkký jako bahno a může se vyskytovat jako zhutnělá zemina (sypká i přetmelená), malé kuličky (pisolity) nebo dutý, větvičkovitý materiál (trubičky). Jeho barva může být béžová, růžová, žlutá, červená nebo bílá, případně jejich kombinace. Hliník je také obsažen v mnoha drahých kamenech, jako je tyrkys, rubín, safír, smaragd, topaz, nefrit a akvamarín.
Zdroje
Bauxitová ruda obsahuje dostatečně vysoké množství oxidů hliníku a přiměřeně nízké množství oxidu železa (Fe2O3) a oxidu křemičitého (SiO2), aby se dala ekonomicky těžit. Množství reaktivního oxidu křemičitého je obzvláště důležité, protože tato forma oxidu křemičitého spotřebovává kaustickou sodu potřebnou k výrobě oxidu hlinitého, a proto je žádoucí nízké množství reaktivního oxidu křemičitého. Dalšími potenciálními zdroji hliníku jsou různé horniny a minerály, například hlinité břidlice a břidlice, fosfátové horniny a jíly s vysokým obsahem hliníku.
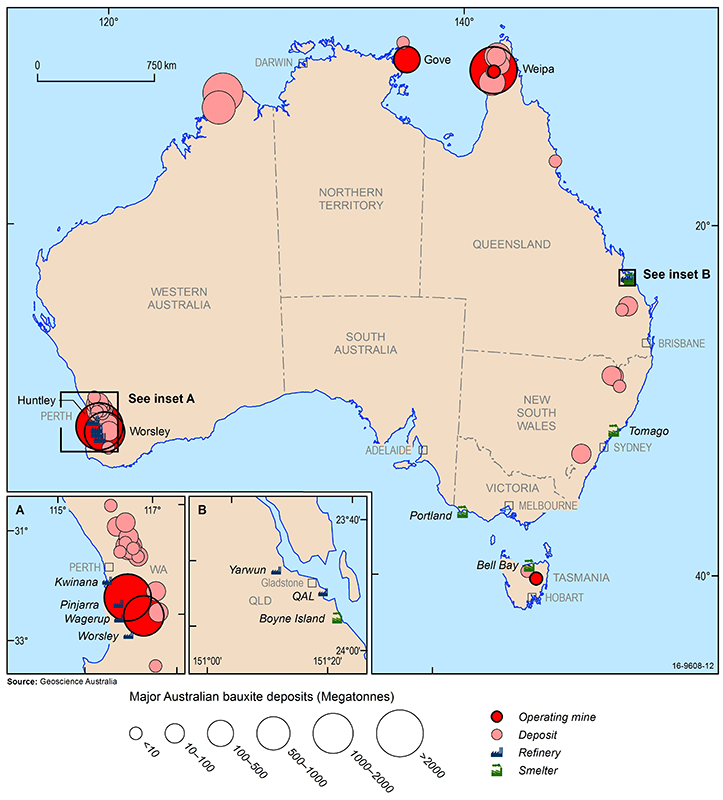
Hlavní ložiska bauxitu, doly, rafinerie oxidu hlinitého a hutě hliníku v Austrálii (2016). Source: Geoscience Australia.
Největší světové ekonomické zdroje bauxitu se vyskytují v Guineji, Austrálii, Brazílii, Vietnamu a na Jamajce. V Austrálii se bauxit těží v zavedených povrchových provozech ve Weipě v Queenslandu, Gove v Severním teritoriu a Darling Range v Západní Austrálii. Kromě toho byly nedávno zahájeny nové doly v oblasti Cape York v Queenslandu a ve střední Tasmánii. Další ložiska bauxitu se nacházejí v severní části Západní Austrálie, Novém Jižním Walesu a východním Queenslandu, ale jejich těžba je v současné době neekonomická.
Australské rafinerie oxidu hlinitého se nacházejí v Západní Austrálii (Kwinana, Wagerup, Pinjarra a Worsely) a Queenslandu (QAL a Yarwun) a hliníkové hutě v Tasmánii (Bell Bay), Queenslandu (Boyne Island), Victorii (Portland) a Novém Jižním Walesu (Tomago). Čína je největším světovým spotřebitelem hliníku a navzdory vysoké domácí produkci dováží velké množství oxidu hlinitého a surového bauxitu, což představuje více než 40 % celosvětové spotřeby. Dalšími velkými trhy s hliníkem jsou Spojené státy americké, Japonsko a Evropa, ale tyto regiony mají jen malá ekonomická ložiska bauxitu a jsou rovněž závislé na dovozu bauxitu a oxidu hlinitého pro své rafinerie oxidu hlinitého a hliníkové hutě.
Další informace o zdrojích a výrobě.
Těžba
Těžba kovového hliníku probíhá ve třech hlavních fázích¿ těžba bauxitové rudy, rafinace rudy za účelem získání oxidu hlinitého a tavení oxidu hlinitého k výrobě hliníku. Bauxit se těží povrchovými metodami (povrchová těžba), při nichž se svrchní vrstva půdy a nadloží odstraňují buldozery a škrabáky. Svrchní vrstva půdy se ukládá a později se používá k obnově vegetace a rekultivaci oblasti po ukončení těžby. Podložní bauxit se těží pomocí čelních nakladačů, motorových lopat nebo hydraulických rypadel. Některé bauxitové rudy se pouze drtí, suší a přepravují. Jiné bauxity se po rozdrcení upravují promýváním, aby se odstranila část jílu, reaktivního oxidu křemičitého a odpadního písku, a poté se suší v rotačních pecích. Ruda se nakládá do nákladních aut, železničních vagónů nebo na dopravníkové pásy a přepravuje se na lodě nebo do rafinerií.
Řada faktorů výrobního cyklu hliníku se týká životního prostředí a na minimalizaci dopadu těžby, rafinace a tavení na okolní prostředí jsou vynakládány značné prostředky. Provádí se rekultivace dolů s maximálním úsilím o navrácení oblasti alespoň do původního stavu. Opatrně se nakládá s červeným bahnem z rafinerií a jeho likvidací. Toto bahno se obvykle čerpá do přehrad, které jsou utěsněny nepropustným materiálem, aby se zabránilo znečištění okolní krajiny.
Zpracování
Téměř ve všech komerčních provozech se oxid hlinitý získává z bauxitu Bayerovým rafinačním procesem. Tento proces, který objevil Karl Josef Bayer v roce 1888, se skládá ze čtyř fází.
Degradace: jemně rozemletý bauxit se přivádí do jednotky vyhřívané párou, která se nazývá digester. Zde se pod tlakem smísí s horkým roztokem kaustické sody. Oxid hlinitý z bauxitu (a reaktivní oxid křemičitý) reaguje s kaustickou sodou za vzniku roztoku hlinitanu sodného neboli zeleného louhu a sraženiny křemičitanu hlinito-hlinitého.
Čištění: zelený louh neboli roztok obsahující oxid hlinitý se oddělí od odpadu – nerozpuštěných oxidů železa a oxidu křemičitého, které byly součástí původního bauxitu a nyní tvoří odpadní písek a červené bahno. Tato fáze zahrnuje tři kroky: nejprve se odstraní hrubý odpad o velikosti písku a promyje se, aby se získala kaustická soda; dále se oddělí červené bahno; a nakonec se zbývající zelený louh přečerpá přes filtry, aby se odstranily veškeré zbytkové nečistoty. Písek a bahno se společně odčerpají do zbytkových jezer a zelený louh se odčerpá do výměníků tepla, kde se ochladí z 1000 °C na přibližně 650-790 °C.
Srážení: oxid hlinitý se z louhu vysráží ve formě krystalů hydrátu oxidu hlinitého. Za tímto účelem se roztok zeleného louhu mísí ve vysokých srážecích nádobách s malým množstvím jemného krystalického oxidu hlinitého, který při ochlazování roztoku stimuluje srážení pevného hydrátu oxidu hlinitého. Po dokončení se pevný hydrát oxidu hlinitého předá do další fáze a zbývající louh, který obsahuje kaustickou sodu a trochu oxidu hlinitého, se vrátí zpět do fermentorů.
Kalcinace: hydrát oxidu hlinitého se promyje, aby se odstranil veškerý zbývající louh, a poté se vysuší. Nakonec se zahřeje na teplotu přibližně 1000 °C, aby se z něj vypudila krystalizační voda, a zůstane z něj oxid hlinitý – suchý, čistě bílý, písčitý materiál. Část oxidu hlinitého může být ponechána ve formě hydrátu nebo dále zpracována pro chemický průmysl.
Hliník se tavením mění na hliník. Veškerá komerční výroba hliníku je založena na Hall-Héroultově procesu tavení, při kterém se hliník a kyslík v oxidu hlinitém oddělují elektrolýzou. Elektrolýza zahrnuje průchod elektrického proudu roztaveným roztokem oxidu hlinitého a přírodního nebo syntetického kryolitu (fluoridu hlinito-sodného). Roztavený roztok je obsažen v redukčních článcích nebo nádobách, které jsou na dně vyloženy uhlíkem (katodou) a jsou zapojeny do elektrické řady zvané potline. V horní části každé nádoby jsou vloženy uhlíkové anody, jejichž dna jsou ponořena do roztaveného roztoku.
Průchodem elektrického proudu dochází ke slučování kyslíku z oxidu hlinitého s uhlíkem anody za vzniku plynného oxidu uhličitého. Zbývající roztavený kovový hliník se shromažďuje na katodě na dně nádoby. Pravidelně se odčerpává a převádí do velkých skladovacích pecí. Odstraňují se nečistoty, přidávají se legující prvky a roztavený hliník se odlévá do ingotů.
Tavicí proces je kontinuální. Jak se snižuje obsah oxidu hlinitého v kryolitové lázni, přidává se další. Teplo vznikající průchodem elektrického proudu udržuje kryolitovou lázeň v roztaveném stavu, takže dochází k rozpouštění oxidu hlinitého. Při tavbě se spotřebuje velké množství energie; na výrobu jedné tuny hliníku z přibližně dvou tun oxidu hlinitého je zapotřebí 14 000 až 16 000 kilowatthodin elektrické energie. Hliník se někdy označuje jako „pevná elektřina“ vzhledem k velkému množství energie spotřebované při jeho výrobě. Dostupnost levné elektřiny je proto pro ekonomickou výrobu nezbytná.
Hliníkové ingoty se vyrábějí v různých tvarech a velikostech v závislosti na jejich konečném použití. Mohou být válcovány do desek, plechů, fólií, tyčí nebo prutů. Mohou být taženy do drátů, které jsou splétány do kabelů pro elektrická přenosová vedení. Lisy lisují ingoty do stovek různých užitných a dekorativních tvarů nebo je výrobní závody mohou zpracovávat do velkých konstrukčních tvarů.