Chemistry for Non-Majors
Learning Objectives
- Definice atomového poloměru.
- Popsat, jak se mění atom v rámci periody.
- Popsat, jak se mění atomový poloměr v rámci skupiny.
Jak se všichni ti lidé mohou vejít do tak malého prostoru?“
 Události přitahují velké množství lidí. I venkovní akce se může zaplnit tak, že už není místo pro další lidi. Kapacita davu závisí na množství prostoru v místě konání a množství prostoru závisí na velikosti objektů, které jej zaplňují. Do daného prostoru můžeme dostat více lidí než slonů, protože sloni jsou větší než lidé. Ze stejného důvodu můžeme do stejného prostoru dostat více veverek než lidí. Znalost velikosti objektů, s nimiž máme co do činění, může být důležitá při rozhodování o tom, kolik prostoru potřebujeme.
Události přitahují velké množství lidí. I venkovní akce se může zaplnit tak, že už není místo pro další lidi. Kapacita davu závisí na množství prostoru v místě konání a množství prostoru závisí na velikosti objektů, které jej zaplňují. Do daného prostoru můžeme dostat více lidí než slonů, protože sloni jsou větší než lidé. Ze stejného důvodu můžeme do stejného prostoru dostat více veverek než lidí. Znalost velikosti objektů, s nimiž máme co do činění, může být důležitá při rozhodování o tom, kolik prostoru potřebujeme.
Velikost atomů je důležitá, když se snažíme vysvětlit chování atomů nebo sloučenin. Jedním ze způsobů, jak můžeme vyjádřit velikost atomů, je atomový poloměr . Tento údaj nám pomáhá pochopit, proč se některé molekuly k sobě hodí a proč mají jiné molekuly za určitých podmínek příliš přeplněné části.
Velikost atomu je definována hranou jeho orbitalu. Hranice orbitalů jsou však nejasné a ve skutečnosti jsou za různých podmínek proměnlivé. Za účelem standardizace měření atomových poloměrů se měří vzdálenost mezi jádry dvou stejných atomů spojených dohromady. Atomový poloměr je definován jako polovina vzdálenosti mezi jádry stejných atomů, které jsou spolu vázány.

Obrázek 1. Znázornění atomového poloměru. Atomový poloměr (r) atomu lze definovat jako polovinu vzdálenosti (d) mezi dvěma jádry v dvouatomové molekule.
Atomové poloměry byly změřeny u prvků. Jednotkami pro atomové poloměry jsou pikometry, které se rovnají 10-12 metrům. Jako příklad lze uvést mezijadernou vzdálenost mezi dvěma atomy vodíku v molekule H2, která byla změřena a činí 74 pm. Atomový poloměr atomu vodíku je tedy \frac{74}{2}=37\text{ pm}.
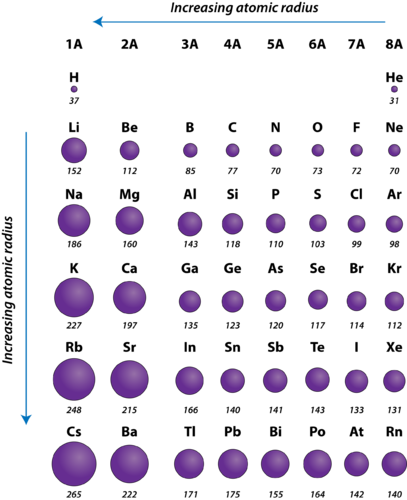
Obrázek 2. Atomové poloměry reprezentativních prvků měřené v pikometrech.
Periodický trend
Atomový poloměr atomů obecně klesá zleva doprava napříč periodou. Existují drobné výjimky, například poloměr kyslíku je o něco větší než poloměr dusíku. V rámci periody přibývají v jádře protony, protože na stejné hlavní energetické hladině přibývají elektrony. Tyto elektrony jsou postupně přitahovány blíže k jádru, protože se zvyšuje jeho kladný náboj. Protože se přitažlivá síla mezi jádry a elektrony zvyšuje, velikost atomů se zmenšuje. Tento efekt se zmenšuje s postupem dále doprava v periodě kvůli odpuzování elektronů, které by jinak způsobilo zvětšení velikosti atomu.
Trend skupiny
Atomový poloměr atomů se v rámci skupiny obecně zvětšuje shora dolů. S rostoucím atomovým číslem směrem dolů ve skupině dochází opět k nárůstu kladného jaderného náboje. Dochází však také k nárůstu počtu obsazených principiálních energetických hladin. Vyšší hlavní energetické hladiny se skládají z orbitalů, které jsou větší než orbitaly z nižších energetických hladin. Vliv většího počtu hlavních energetických hladin převažuje nad nárůstem jaderného náboje, a tak se atomový poloměr směrem dolů po skupině zvětšuje.

Obrázek 3. Vliv většího počtu hlavních energetických hladin převažuje nad nárůstem jaderného náboje. A graph of atomic radius plotted versus atomic number. Each successive period is shown in a different color. As the atomic number increases within a period, the atomic radius decreases.
Summary
- Atomic radius is determined as the distance between the nuclei of two identical atoms bonded together.
- The atomic radius of atoms generally decreases from left to right across a period.
- The atomic radius of atoms generally increases from top to bottom within a group.
Practice
Use the link below to answer the following questions:
http://chemwiki.ucdavis.edu/Inorganic_Chemistry/Descriptive_Chemistry/Periodic_Table_of_the_Elements/Atomic_Radi
- What influences the atomic size of an atom?
- What is a covalent radius?
- What is an ionic radius?
Review
- Define „atomic radius.“
- What are the units for measurement of atomic radius?
- How does the atomic radius change across a period?
- How does atomic radius change from top to bottom within a group?
- Explain why the atomic radius of hydrogen is so much smaller that the atomic radius for potassium.