H2S Lewis Structure, Molecular Geometry, Hybridization and Polarity
Hydrogen Sulfide is a common chemical compound that is useful for analyzing inorganic compounds of metal ions. It has the chemical formula of H2S. The molecule has two Hydrogen atoms and a single Sulfur atom. H2S is also a precursor for elemental Sulfur. It also plays a vital role in signaling pathways in the human body. So to understand the hybridization, polarity, and molecular geometry of this compound, it is essential to know its Lewis structure.
| Name of molecule | Hydrogen Disulfide ( H2S) |
| No of Valence Electrons in the molecule | 8 |
| Hybridization of CO2 | sp3 hybridization |
| Bond Angles | 104.5 degrees |
| Molecular Geometry of CO2 | Bent |
Before knowing its Lewis structure, let us calculate the total number of valence electrons in Hydrogen Sulfide as these electrons participate in bond formation and help us study Lewis structure with ease.
Contents
Valence electrons of H2S
To know the total number of valence electrons in Hydrogen Sulfide we need to add the valence electrons of both Hydrogen and Sulfur atoms. There are two atoms of Hydrogen and a single atom of Sulfur in the compound.
Each Hydrogen atom has only one electron which is also its valence electron
Hence there are two valence electrons for Hydrogen atom ( as there are two Hydrogen atoms)
Sulfur has six valence electrons.
Total number of valence electrons in H2S
= 2(1) + 6
= 8
Thus, there are a total of eight valence electrons in H2S.
Lewisova struktura H2S
Lewisova struktura jakékoli sloučeniny je strukturní znázornění valenčních elektronů, které se podílejí na vzniku vazby, spolu s nevazebnými elektronovými páry. Znalost Lewisovy struktury dané chemické sloučeniny je nezbytná, protože poskytuje potřebné informace o všech dalších chemických vlastnostech sloučeniny.
Zobrazení je zobrazeno pomocí teček a čar, které představují elektrony. Tečky představují elektrony, které se nepodílejí na tvorbě vazby. Zatímco čáry představují vazby ve sloučenině. Struktura je vytvořena na základě oktetového pravidla. Pravidlo oktetu v chemii říká, že ve vnější slupce prvku by mělo být osm elektronů, aby byl prvek stabilní.
Lwisova struktura sulfidu vodíku je snadno nakreslitelná a pochopitelná. V této sloučenině potřebují oba atomy vodíku jeden elektron k vytvoření kovalentní vazby se sírou. Lewisova struktura H2S je podobná struktuře H2S. Síra potřebuje osm elektronů, aby splnila požadavky oktetového pravidla. Vodík však potřebuje pouze jeden elektron, aby se stal stabilním, protože patří do skupiny prvků 1.
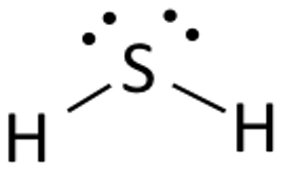
Umístěte atom síry doprostřed a uspořádejte kolem něj jeho valenční elektrony.
Nyní umístěte dva atomy vodíku po obou stranách středového atomu.
Tady jsou valenční elektrony síry použity k tomu, aby byl vodík stabilní tím, že oběma atomům vodíku darují elektron. Na tvorbě vazby se podílejí dva ze šesti valenčních elektronů.
Nakreslete čáry ( pro znázornění vazeb) mezi atomy Vodíku a Síry.
Zbývající čtyři elektrony jsou nevazebné elektrony, a proto jsou zobrazeny jako tečky v blízkosti atomu síry. Celkem jsou v této sloučenině dva páry nevazebných elektronů a atomy Vodíku mají úplnou valenční slupku.
Hybridizace H2S
Pro pochopení hybridizace H2S je nezbytné znát nejprve dvě věci:
- Počet vazeb ve sloučenině a jejich typ
Pro poznání hybridizace sloučeniny je nezbytné znát typ vazby ve sloučenině. V molekule H2S tvoří dva atomy vodíku vazbu s centrálním atomem síry. V molekule vznikají dvě jednoduché vazby. Tyto vazby zabírají čtyři valenční elektrony, a proto zbývají čtyři další valenční elektrony. Při vytváření vazby se s orbital atomu Vodíku překrývá s p orbitalem atomu Síry. Osamělý pár elektronů zabírá dva z orbitalů sp3. Zbývající dva orbitaly sp3 se překrývají s orbitalem 1s atomu Vodíku.
Toto uspořádání vede k hybridizaci sp3 molekuly H2S. Překrytí dvou hybridních orbitalů vytváří dvě sigma vazby mezi atomem Vodíku a atomem Síry.
- Sterické číslo dané sloučeniny
Sterické číslo je definováno jako oblast elektronové hustoty pozorované kolem centrálního atomu. V tomto případě, protože centrálním atomem je Síra, bude sterické číslo sloučeniny tvořit kumulativní součet atomů vázaných na centrální atom a počet osamělých párů elektronů kolem centrálního atomu.
Vzorec pro zjištění tohoto čísla je:
Sterické číslo (SN)
= počet vazeb sigma na centrálním atomu + počet osamělých párů pí na centrálním atomu
V tomto případě molekuly H2S jsou dvě vazby sigma a na centrálním atomu jsou dva osamělé páry elektronů.

Tak SN molekuly H2S = 2+2
=4
Jelikož je sterické číslo H2S čtyři, má dvě
hybridní orbitaly a dva osamělé páry elektronů, které z ní dělají sp3 hybridizaci.
Teď, když známe Lewisovu strukturu a hybridizaci molekuly, je snadné určit její molekulární geometrii.
Molekulární geometrie H2S
Hybridizace dané molekuly H2S je sp3; atom síry je ve středové vazbě se dvěma atomy vodíku, které tvoří vazebný úhel menší než 180 stupňů. Podle teorie VSEPR se osamělé páry elektronů vzájemně odpuzují, ale protože atom síry je méně elektronegativní, vazebný úhel se zmenší na 104,5 stupně.
Toto zmenšení úhlu vede k ohnuté struktuře.
Dalším způsobem, jak poznat molekulovou geometrii, je metoda AXN. Kde A označuje centrální atom, X je pro počet vázaných párů elektronů a N je pro osamělý pár elektronů. Zde bude obecný vzorec AX2N2 kvůli dvěma vazebným párům a dvěma osamělým párům elektronů. Tato molekula tedy vykazuje ohnutou geometrii.
Polarita H2S
Teď, když máme potřebné informace o molekule, je snadné určit její polaritu. Polarita každé molekuly závisí na její molekulární geometrii a celkové elektronegativitě. Protože atom síry je méně elektronegativní, je celková elektronegativita sloučeniny menší než 0,4, což ji činí nepolární.
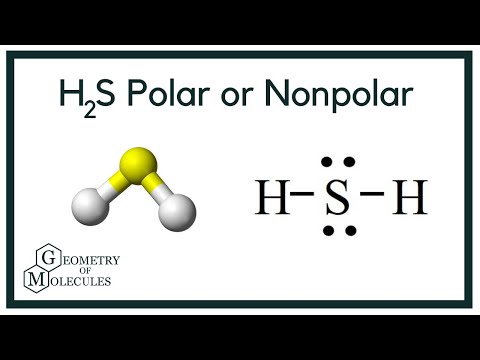
Tak lze říci, že molekula H2S je nepolární.
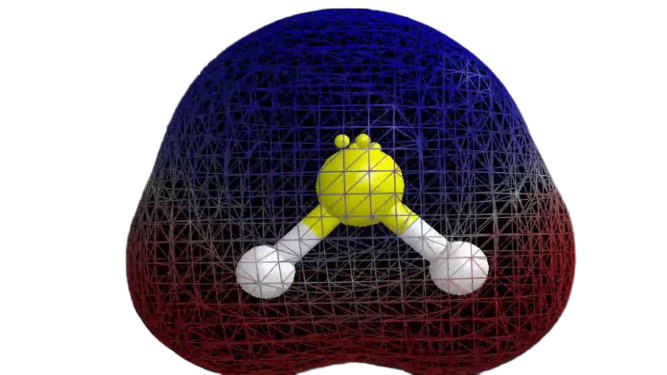
Závěrečné poznámky
Z výše uvedených informací lze vyvodit, že molekula H2S má osm valenčních elektronů, sp3 hybridizaci, ohnutou molekulovou geometrii a je nepolární.