Kyslíková rodina
Kyslíková rodina se skládá z prvků, které tvoří 16. skupinu periodické tabulky prvků: kyslík, síra, selen, tellur a polonium. Všechny tyto prvky mají na své nejvzdálenější energetické hladině šest elektronů, což je příčinou některých společných chemických vlastností mezi nimi. V jiném ohledu se od sebe tyto prvky značně liší. Kyslík je plynný nekov, síra a selen jsou pevné nekovy, tellur je pevný metaloid a polonium je pevný kov.
Slova, která je třeba znát
Kyselina: Látky, které jsou po rozpuštění ve vodě schopny reagovat se zásadou za vzniku solí a uvolňovat vodíkové ionty.
Alotrop: Jedna ze dvou nebo více forem prvku.
Hoření: Forma oxidace, která probíhá tak rychle, že vzniká znatelné teplo a světlo.
Krakování: Proces, při kterém se velké molekuly uhlovodíků rozkládají na menší složky.
Elektrolýza: Proces, při kterém elektrický proud způsobuje chemickou změnu, obvykle rozklad nějaké látky.
Izotopy: Dvě nebo více forem téhož prvku se stejným počtem protonů, ale různým počtem neutronů v atomovém jádře.
Litosféra: Je to pevná část Země, zejména vnější část zemské kůry.
LOX: Zkratka pro kapalný kyslík.
Hutnictví: Vědní obor a technologie, které se zabývají získáváním kovů z jejich rud a jejich přeměnou na formy, které mají praktickou hodnotu.
Vznikající kyslík: Alotrop kyslíku, jehož každá molekula obsahuje jeden atom kyslíku.
Ozon: Alotrop kyslíku, který se skládá ze tří atomů v jedné molekule.
Výrobní plyn: Syntetické palivo, které se skládá především z oxidu uhelnatého a plynného vodíku.
Bílkoviny: Velké molekuly, které jsou nezbytné pro strukturu a fungování všech živých buněk.
Radioaktivní rozpad: Předvídatelný způsob, jakým se populace atomů radioaktivního prvku v průběhu času samovolně rozpadá.
Kyslík
Kyslík je bezbarvý plyn bez zápachu a chuti s bodem tání -218 °C a bodem varu -183 °C. Kyslík je bezbarvý plyn bez zápachu a chuti. Je nejrozšířenějším prvkem v zemské kůře, tvoří asi čtvrtinu hmotnosti atmosféry, asi polovinu litosféry (zemské kůry) a asi 85 % hydrosféry (oceány, jezera a další formy vody). Vyskytuje se jako volný prvek i ve velkém množství sloučenin. V atmosféře se vyskytuje jako elementární kyslík, někdy označovaný jako dioxygen, protože se skládá z dvouatomových molekul O 2 . Ve vodě se vyskytuje jako oxid vodíku, H 2 O, a v litosféře se vyskytuje ve sloučeninách, jako jsou oxidy, uhličitany, sírany, křemičitany, fosforečnany a dusičnany.
Kyslík existuje také ve dvou alotropních formách (fyzikálně nebo chemicky odlišné formy téže látky): jeden atom v molekule (O) a tři atomy v molekule (O 3 ). První alotropní forma je známá jako monatomický neboli nascentní kyslík a druhá jako triatomický kyslík neboli ozon. Za většiny okolností v přírodě převažuje dvouatomární forma kyslíku. V horní části stratosféry však sluneční energie způsobuje rozklad diatomické formy na monatomickou formu, která pak může rekombinovat s diatomickými molekulami za vzniku ozonu. Přítomnost ozonu v zemské atmosféře má zásadní význam pro přežití života na Zemi, protože tento alotrop má tendenci pohlcovat ultrafialové záření, které by jinak bylo pro rostlinný i živočišný svět na povrchu planety škodlivé nebo dokonce smrtelné.
Kyslík objevili nezávisle na sobě švédský chemik Carl Scheele (1742-1786) a anglický chemik Joseph Priestley (1733-1804) v letech 1773 až 1774. Název prvku dal koncem 70. let 19. století francouzský chemik Antoine Laurent Lavoisier (1743-1794). Jeho název pochází z francouzského slova „kyselinotvorný“, což odráží Lavoisierův nesprávný názor, že všechny kyseliny obsahují kyslík.
Výroba. Zdaleka nejběžnějším způsobem komerční výroby kyslíku je frakční destilace kapalného vzduchu. Vzorek vzduchu se nejprve ochladí na velmi nízkou teplotu v rozmezí -200 °C (-330 °F). Při této teplotě se většina plynů tvořících vzduch stává kapalnou. Kapalný vzduch se pak nechá odpařit. Při teplotě přibližně -196 °C se dusík začne vypařovat. Když většina dusíku zmizí, vyvaří se také argon a neon a zůstane nečistá forma kyslíku. Kyslík je nečistý, protože v kapalné formě může zůstat malé množství kryptonu, xenonu a dalších plynů. Aby se kyslík dále čistil, může se proces chlazení, zkapalňování a odpařování opakovat.
Kyslík se běžně skladuje a přepravuje v kapalné formě, což je forma známá také jako LOX (pro l iquid ox ygen). Zásobníky LOX vypadají jako velmi velké vakuové láhve sestávající z dvoustěnné nádoby, mezi jejímiž stěnami je vakuum. Prvek lze také méně snadno skladovat a přepravovat v plynné formě v kontejnerech s ocelovými stěnami o výšce asi 1,2 m a průměru 23 cm. V mnoha případech se kyslík vyrábí na místě, kde bude použit. Proces frakční destilace popsaný výše je dostatečně jednoduchý a levný, takže mnoho průmyslových odvětví si může zajistit vlastní zařízení na výrobu kyslíku.
Použití. Kyslík má tolik komerčních, průmyslových a dalších využití, že se trvale řadí mezi pět nejvýznamnějších chemických látek z hlediska objemu výroby ve Spojených státech. Například v roce 1990 bylo ve Spojených státech vyrobeno přibližně 18 miliard kilogramů (39 miliard liber) tohoto prvku.
Použití kyslíku lze rozdělit do čtyř hlavních kategorií: metalurgie, raketová technika, chemická syntéza a medicína. Například při zpracování železné rudy ve vysoké peci se kyslík používá k přeměně koksu (uhlíku) na oxid uhelnatý. Oxid uhelnatý zase redukuje oxidy železa na čistý železný kov. Kyslík se pak používá ve druhém kroku zpracování železa v Bessemerově konvertoru, v otevřeném ohništi nebo v základním kyslíkovém procesu při přeměně surového železa na ocel. V tomto kroku se kyslík používá k reakci s přebytečným uhlíkem, křemíkem a kovy, které zůstávají v surovém železe a které musí být odstraněny, aby se vyrobila ocel.
Další metalurgické využití kyslíku je v hořácích používaných ke svařování a řezání. Dva nejběžnější hořáky využívají reakci mezi kyslíkem a vodíkem (kyslíkovodíkový hořák) nebo mezi kyslíkem a acetylenem (kyslíkoacetylenový hořák). Oba druhy hořáků vytvářejí teploty v rozmezí 3 000 °C a více, a proto je lze použít k řezání nebo svařování velké většiny kovových materiálů.
Ve formě LOX se kyslík široce používá jako oxidační činidlo v mnoha druzích raket a střel. Například obrovská vnější palivová nádrž potřebná k vynesení raketoplánu do vesmíru obsahuje 550 000 litrů kapalného kyslíku a 1 500 000 litrů kapalného vodíku. Když tyto dva prvky reagují v hlavních motorech raketoplánu, poskytují maximální tah 512 000 liber.
V chemickém průmyslu se každoročně spotřebuje obrovské množství kyslíku při různých reakcích chemické syntézy (tvorby). Jednou z nejdůležitějších z nich je krakování uhlovodíků kyslíkem. Za většiny okolností dochází při zahřívání uhlovodíku kyslíkem ke spalování, jehož hlavními produkty jsou oxid uhličitý a voda. Pokud se však pečlivě řídí rychlost, s jakou se do směsi uhlovodíků přivádí kyslík, dochází ke „štěpení“ uhlovodíků za vzniku dalších produktů, jako je acetylen, ethylen a propylen.
S kyslíkem jako jedním z hlavních reaktantů lze také vyrábět různé typy syntetických paliv. Výrobní plyn se například vyrábí průchodem kyslíku řízenou rychlostí vrstvou žhavého uhlí nebo koksu. Většina oxidu uhličitého vznikajícího při této reakci se redukuje na oxid uhelnatý, takže konečný produkt (generátorový plyn) se skládá především z oxidu uhelnatého a vodíku.
Snad nejznámějším lékařským využitím kyslíku je kyslíková terapie, kdy se pacientům, kteří mají potíže s dýcháním, podávají dávky čistého nebo téměř čistého kyslíku. Kyslíková terapie se často používá při chirurgických zákrocích, při porodu, při rekonvalescenci po infarktu a při léčbě infekčních onemocnění. V každém případě se podáváním čistého kyslíku snižuje zátěž srdce a plic a urychluje se tak uzdravení.
Čistý kyslík nebo vzduch obohacený kyslíkem lze poskytovat také v prostředí, kde může být dýchání obtížné. Letadla, která létají ve velkých výškách, jsou samozřejmě vždy vybavena zásobami kyslíku pro případ problémů s běžným zásobováním lodi vzduchem. Hlubinní potápěči s sebou také nosí nebo mají čerpané zásoby vzduchu obohaceného kyslíkem.
Kyslík využívají i některé čistírny vody a čističky odpadních vod. Plyn se čerpá do vody, aby se zvýšila rychlost, s jakou přirozeně se vyskytující bakterie rozkládají organické odpadní látky. Bylo zjištěno, že podobný proces snižuje rychlost, s jakou dochází k eutrofizaci jezer a rybníků, a v některých případech tento proces skutečně obrací. (Eutrofizace je rozpouštění živin ve vodě. Růst vodních rostlin a pokles rozpuštěného kyslíku jsou dva hlavní důsledky tohoto procesu).
V neposlední řadě je kyslík nezbytný pro veškerý život živočichů na Zemi. Člověk může přežít několik dní nebo týdnů bez vody nebo potravy, ale ne déle než několik minut bez kyslíku. Při nedostatku kyslíku by skončily chemické reakce vytvářející energii, které probíhají v buňkách, a člověk by zemřel.
Síra
Síra je nekovový prvek, který může existovat v mnoha alotropických formách (fyzikálně nebo chemicky odlišné formy téže látky). Nejznámější se nazývají kosočtverečná a monoklinická síra. Obě jsou jasně žluté pevné látky s teplotou tání přibližně 115 °C. Třetí forma se nazývá plastická nebo amorfní síra. Je to nahnědlá kapalina, která vzniká při tavení kosočtverečné nebo monoklinické síry.
Síra sama o sobě nemá žádný zápach. V tomto ohledu má však špatnou pověst, protože některé její nejběžnější sloučeniny mají silný zápach. Oxid siřičitý, jedna z těchto sloučenin, má ostrý, dusivý a dusivý účinek na každého, kdo se ho nadýchá. Biblický „oheň a síra“ byl jedním z nejhorších trestů, které si jeho autoři dokázali představit. Síra v tomto výrazu označovala hořící síru neboli oxid siřičitý. Skutečnost, že síra pochází z hlubin pod zemí a že oxid siřičitý je cítit ve výparech sopek, dále podporovala představy lidí o tom, jak musí vypadat peklo.
Druhou sloučeninou síry s nepříjemným zápachem je sirovodík. Silný zápach zkažených vajec je způsoben přítomností této sloučeniny.
Výskyt a příprava. Síra je šestnáctým nejrozšířenějším prvkem v zemské kůře. Vyskytuje se jak jako prvek, tak v různých sloučeninách. Jako prvek se vyskytuje ve velmi rozsáhlých podzemních dolech, nejčastěji na pobřeží Mexického zálivu ve Spojených státech a v Polsku a na Sicílii. Síra se z těchto dolů získává Fraschovým procesem. Při tomto procesu se přehřátá pára čerpá přes nejvzdálenější ze souboru tří trubek. Do nejvnitřnějšího potrubí se vhání stlačený vzduch. Přehřátá pára způsobí roztavení podzemní síry a stlačený vzduch ji vytlačí prostředním ze tří potrubí na zemský povrch.
Síra je také široce rozšířena ve formě minerálů a rud. Mnoho z nich je ve formě síranů, včetně sádrovce (síran vápenatý, CaSO 4 ), barytu (síran barnatý, BaSO 4 ) a epsomské soli (síran hořečnatý, MgSO 4 ). Dalšími jsou sulfidy kovů, včetně pyritu železa (sulfid železa, FeS 2 ), galenitu (sulfid olova, PbS), cinabaru (sulfid rtuťnatý, HgS), stibnitu (sulfid antimonitý, Sb 2 S 3 ) a zinkové blendy (sulfid zinečnatý, ZnS). Síra se z těchto kovových rud získává silným zahříváním na vzduchu, čímž se síra přemění na oxid siřičitý a uvolní se čistý kov. Oxid siřičitý pak může jít přímo do výroby kyseliny sírové, kde končí více než 90 % celosvětově vytěžené síry.
Využití síry a jejích sloučenin. Část síry se používá přímo jako fungicid a insekticid, v zápalkách, ohňostrojích a střelném prachu a při vulkanizaci přírodního kaučuku (úprava, která dodává kaučuku pružnost a pevnost). Většina se však přeměňuje na množství užitečných sloučenin.
Kyselina sírová je zdaleka nejdůležitější ze všech sloučenin síry. Téměř 90 % veškeré vyrobené síry se nejprve přemění na oxid siřičitý a poté na kyselinu sírovou. Tato kyselina se trvale řadí na první místo mezi chemickými látkami vyráběnými ve Spojených státech. V roce 1990 bylo vyrobeno více než 40 miliard kilogramů (89 miliard liber) kyseliny sírové, což je o více než 50 procent více než druhá nejoblíbenější chemikálie (plynný dusík). Kyselina sírová se používá při výrobě hnojiv, automobilových baterií, ropných produktů, pigmentů, železa a oceli a mnoha dalších výrobků.
Koloběh síry. Stejně jako dusík, uhlík a fosfor prochází síra plynnou, kapalnou a pevnou částí naší planety v sérii nepřetržitých reakcí známých jako koloběh síry. Hlavní kroky koloběhu síry jsou znázorněny na přiloženém obrázku.
Síra vzniká přirozeně v důsledku sopečných erupcí a emisí z horkých pramenů. Do atmosféry se dostává především ve formě oxidu siřičitého, v této formě pak zůstává v atmosféře nebo po reakci s vodou ve formě kyseliny sírové. Při dešti nebo sněžení se síra dostává zpět na zemský povrch jako kyselá depozice.
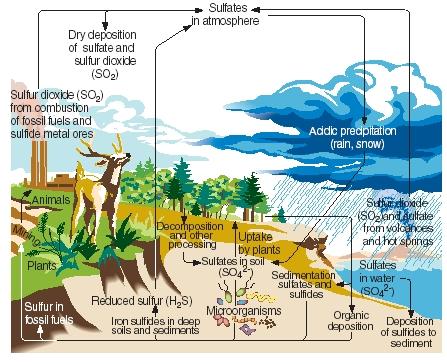
.)
Na povrchu Země reagují oxid siřičitý a kyselina sírová s kovy za vzniku síranů a sulfidů. Prvek je také zabudováván rostlinami ve formě známé jako organická síra. Některé aminokyseliny, sloučeniny, z nichž se tvoří bílkoviny, obsahují síru. Organická síra z rostlin nakonec přechází na živočichy, kteří se těmito rostlinami živí. Z rostlinných bílkovin se pak přeměňuje na živočišné bílkoviny.
Když rostliny a živočichové uhynou, síra se vrací do půdy, kde ji mikroorganismy přemění na sirovodík. Plynný sirovodík se pak vrací do atmosféry, kde se oxiduje na kyselinu sírovou.
Lidská činnost ovlivňuje koloběh síry několika způsoby. Například při těžbě uhlí a kovových rud se může uvolňovat síra a sulfidy, které se vracejí do půdy. Také při spalování uhlí, ropy a zemního plynu se do atmosféry často uvolňuje oxid siřičitý. Tento oxid siřičitý se přidává k množství již přítomnému z přírodních zdrojů a výrazně zvyšuje množství kyselých srážek, které dopadají na zemský povrch. Někteří lidé se domnívají, že kyselé srážky (neboli kyselý déšť) jsou zodpovědné za odumírání stromů a dalších rostlin, okyselení jezer, které poškodilo mořské živočichy, poškození kovových a kamenných konstrukcí a další škody na životním prostředí.
Selen, tellur a polonium
Selen a tellur jsou poměrně vzácné prvky. Z hlediska výskytu se řadí mezi posledních deset procent všech prvků. V zemské kůře se obvykle vyskytují ve spojení s rudami mědi a dalších kovů. Oba se získávají jako vedlejší produkt při elektrolytické rafinaci mědi. Během tohoto procesu klesají na dno elektrolýzní nádrže, kde mohou být odstraněny ze vznikajícího kalu.
Selen se vyskytuje v různých alotropních formách (fyzikálně nebo chemicky odlišné formy téže látky), z nichž nejběžnější je červený prášek, který na vzduchu zčerná. Teplota tání tohoto prvku je 217 °C a jeho teplota varu je 685 °C, což je 1 265 °F. Tellur je stříbřitě bílá pevná látka, která vypadá jako kov (ačkoli se ve skutečnosti jedná o metaloid). Jeho teplota tání je 450 °C (842 °F) a teplota varu 990 °C (1 814 °F).
Selen má v živých organismech zajímavou úlohu. Ve velmi nízkých koncentracích je nezbytný pro udržení zdraví většiny živočichů. Ve skutečnosti se často přidává do krmiv pro zvířata. Ve vyšších koncentracích však bylo zjištěno, že tento prvek má na zvířata škodlivé účinky a způsobuje deformace mláďat a onemocnění dospělých jedinců.
Hlavní využití selenu je v elektronice a při výrobě barevného skla. Selen se používá ve fotokopírovacích strojích, solárních článcích, fotočláncích, televizních obrazovkách a elektronických usměrňovačích a relé (slouží k řízení toku elektrického proudu). Některá z nejkrásnějších barevných skel, od světle růžových až po zářivě červené, se vyrábějí ze sloučenin selenu.
Malé množství telluru se používá také při výrobě barevného skla. Více než 90 % tohoto prvku však připadá na výrobu slitin železa a dalších kovů.
Polonium má 27 izotopů, z nichž všechny jsou radioaktivní. Přirozeně se vyskytuje v uranových rudách, kde je konečným produktem v dlouhé řadě reakcí, kterými uran prochází radioaktivním rozpadem. Je to jeden z nejvzácnějších prvků na Zemi, jeho množství nepřesahuje asi 3 × 10 -10 částic na milion. Objev polonia v roce 1898 polsko-francouzskou chemičkou Marií Curie (1867-1934) je jedním z nejdramatičtějších příběhů v historii vědy. Zpracovala tuny uranové rudy, aby získala několik miligramů nového prvku, který pak pojmenovala podle své vlasti Polska. Polonium nachází omezené využití ve vysoce specializovaných zařízeních vyrábějících energii, například v kosmických družicích a sondách.