Principy biologie
Poté, co jsme se dozvěděli, že při chemických reakcích dochází k uvolňování energie při rozpadu vazeb uchovávajících energii, je důležitá následující otázka: Jak se energie spojená s těmito chemickými reakcemi kvantifikuje a vyjadřuje? Jak lze energii uvolněnou při jedné reakci porovnat s energií uvolněnou při jiné reakci? Ke kvantifikaci těchto přenosů energie se používá měření volné energie. Připomeňme si, že podle druhého termodynamického zákona všechny přenosy energie zahrnují ztrátu určitého množství energie v nevyužitelné formě, například v podobě tepla. Volná energie konkrétně označuje energii spojenou s chemickou reakcí, která je k dispozici po započtení ztrát. Jinými slovy, volná energie je využitelná energie nebo energie, která je k dispozici pro vykonání práce. Pokud se na tento pojem podíváme v biologickém smyslu, volná energie je energie v molekule, kterou lze využít k vykonání práce. Glukóza má hodně volné energie, protože ve vazbách molekuly glukózy je uloženo hodně energie. Oxid uhličitý má mnohem nižší volnou energii, protože v jeho vazbách je uloženo mnohem méně energie.
Pokud se při chemické reakci uvolňuje energie, pak změna volné energie z přeměny reaktantů na produkty, označovaná jako ΔG (delta G), bude záporné číslo. Záporná změna volné energie také znamená, že produkty reakce mají menší volnou energii než reaktanty, protože během reakce uvolňují určitou volnou energii. Reakce, které mají zápornou změnu volné energie a v důsledku toho uvolňují volnou energii, se nazývají exergonické reakce. Přemýšlejte: exergonická reakce znamená, že energie ze systému odchází. Tyto reakce se také označují jako spontánní reakce a jejich produkty mají méně uložené energie než reaktanty. Důležité je rozlišovat mezi pojmem spontánní a představou chemické reakce, která probíhá okamžitě. Na rozdíl od každodenního používání tohoto termínu není spontánní reakce taková, která nastane náhle nebo rychle. Rezavění železa je příkladem spontánní reakce, která probíhá pomalu, postupně, v průběhu času.
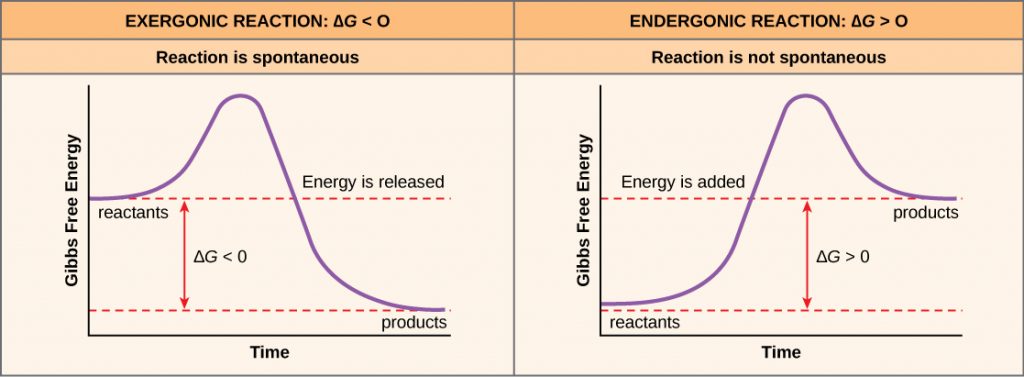
Pokud chemická reakce energii spíše absorbuje, než uvolňuje, pak ΔG pro tuto reakci bude mít kladnou hodnotu. V tomto případě mají produkty více volné energie než reaktanty. Produkty těchto reakcí si tedy můžeme představit jako molekuly uchovávající energii. Tyto chemické reakce se nazývají endergonické reakce a jsou nesamovolné.
Endergonická reakce neproběhne sama o sobě bez přidání volné energie.

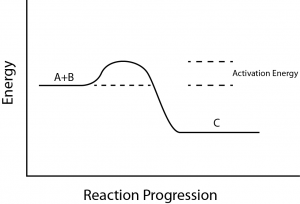
V souvislosti s endergonickými a exergonickými reakcemi je třeba zvážit ještě jeden důležitý pojem. Exergonické reakce vyžadují k rozběhu malé množství vložené energie, než mohou pokračovat ve svých krocích uvolňování energie.
Tyto reakce mají čisté uvolňování energie, ale na začátku stále vyžadují určitý vstup energie. Toto malé množství vložené energie potřebné k tomu, aby všechny chemické reakce proběhly, se nazývá aktivační energie (Obrázek 3).
Pokud není uvedeno jinak, obrázky na této stránce jsou pod licencí CC-BY 4.0 společnosti OpenStax.
Text převzat z: OpenStax, Concepts of Biology. OpenStax CNX. 18. května 2016 http://cnx.org/contents/[email protected]